题目内容
【题目】偏二甲肼与![]() 是常用的火箭推进剂,二者发生如下化学反应:
是常用的火箭推进剂,二者发生如下化学反应:
![]() Ⅰ
Ⅰ![]()
![]() 反应
反应![]() Ⅰ
Ⅰ![]() 中氧化剂是 ______ 。
中氧化剂是 ______ 。
![]() 火箭残骸中常现红棕色气体,原因为:
火箭残骸中常现红棕色气体,原因为:![]()
![]() Ⅱ
Ⅱ![]()
当温度升高时,气体颜色变深,则反应![]() Ⅱ
Ⅱ![]() 为 ______
为 ______ ![]() 填“吸热”或“放热”
填“吸热”或“放热”![]() 反应。
反应。
![]() 一定温度下,反应
一定温度下,反应![]() Ⅱ
Ⅱ![]() 的焓变为
的焓变为![]() 现将
现将![]() 充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是 ______ 。
充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是 ______ 。
若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数 ______ ![]() 填“增大”、“不变”或“减小”
填“增大”、“不变”或“减小”![]() ,反应3s后
,反应3s后![]() 的物质的量为
的物质的量为![]() ,则
,则![]() 的平均反应速率
的平均反应速率 ______
![]() 。
。
![]() 硝酸厂的尾气中含
硝酸厂的尾气中含![]() 和NO,直接排放将污染空气.目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
和NO,直接排放将污染空气.目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
![]()
![]()
则甲烷直接将![]() 还原为
还原为![]() 的热化学方程式为:_________________________________________。
的热化学方程式为:_________________________________________。
![]() 氨气在纯氧中燃烧,也可生成上述反应
氨气在纯氧中燃烧,也可生成上述反应![]() Ⅰ
Ⅰ![]() 产物中的两种.科学家利用此原理,设计成氨气
产物中的两种.科学家利用此原理,设计成氨气![]() 氧气燃料电池,则通入氨气的电极是 ______
氧气燃料电池,则通入氨气的电极是 ______ ![]() 填“正极”或“负极”
填“正极”或“负极”![]() ;碱性条件下,该电极发生反应的电极反应式为__________________________________________________。
;碱性条件下,该电极发生反应的电极反应式为__________________________________________________。
【答案】![]() 吸热
吸热 ![]() 不变
不变 ![]()
![]() 负极
负极 ![]()
【解析】
(1)在氧化还原反应中化合价降低的反应物是氧化剂;
(2)升高温度,平衡向吸热反应方向移动;
(3)根据达到平衡状态,各组分浓度不变,正逆反应速率相等进行判断;
(4)根据盖斯定律进行解答;
(5)原电池中正极得电子发生还原,负极失电子发生氧化反应。
![]() 反应
反应![]() Ⅰ
Ⅰ![]() 中,
中,![]() 中N元素得电子化合价降低,
中N元素得电子化合价降低,![]() 是氧化剂,
是氧化剂,![]() 中碳元素化合价升高,是还原剂,
中碳元素化合价升高,是还原剂,
故答案为:![]() ;
;
![]() 升高温度,化学平衡向吸热反应方向移动,当温度升高时,气体颜色变深,平衡向正反应方向移动,所以正反应是吸热反应;
升高温度,化学平衡向吸热反应方向移动,当温度升高时,气体颜色变深,平衡向正反应方向移动,所以正反应是吸热反应;
故答案为:吸热;
![]() 、反应方程式两边气体的质量不相等,密度不变,说明达到了平衡状态,故a正确;
、反应方程式两边气体的质量不相等,密度不变,说明达到了平衡状态,故a正确;
b、反应过程中,反应热不会变化,不是变量,无法判断是否达到平衡状态,故b错误;
c、根据反应速率大小,无法判断正逆反应速率是否相等,故c错误;
d、四氧化二氮的转化率不变,说明正逆反应速率相等,达到了平衡状态,故d正确;
化学平衡常数只与温度有关,与物质的浓度无关,所以平衡常数K不变;
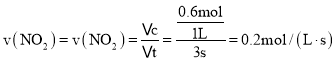 ,则
,则![]() ;
;
故答案为:ad;不变;![]() ;
;
![]() 已知:
已知:![]() ;
;
![]() ,
,
甲烷直接将![]() 还原为
还原为![]() 的化学方程式:
的化学方程式:![]() ,可以由
,可以由![]() 得到,
得到,
所以甲烷直接将![]() 还原为
还原为![]() 的热化学方程式为:
的热化学方程式为:![]() ,
,
故答案为:![]() ;
;
![]() 燃料电池中,燃料做负极,则通入氨气的电极是负极,碱性条件下,总反应:
燃料电池中,燃料做负极,则通入氨气的电极是负极,碱性条件下,总反应: ,正极的电极反应:
,正极的电极反应:![]() ,负极的电极反应式为:
,负极的电极反应式为:![]() ,
,
故答案为:负极;![]() 。
。

【题目】工业上用铬铁矿(主要成分可表示为FeO·Cr2O3,还含有Al2O3、MgCO3、SiO2等杂质)为原料制备重铬酸钾晶体(K2Cr2O7)和铁红的流程如下:
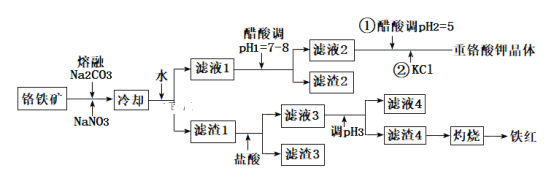
已知:Ⅰ.2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
Ⅱ.常见离子开始生成沉淀和沉淀完全的pH值如下表所示:
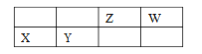
Fe3+ | Al3+ | Mg2+ | SiO32- | AlO2- | |
开始沉淀的pH | 1.9 | 4.2 | 8.1 | 9.5 | 10.2 |
沉淀完全的pH | 3.2 | 5.3 | 9.4 | 8.0 | 8.5 |
(1)铬铁矿反应前需要进行粉碎,目的是________。
(2)熔融Na2CO3条件下主要反应:2FeO·Cr2O3+4Na2CO3+7NaNO3=4Na2CrO4+Fe2O3+4CO2↑+7NaNO2。该反应中的氧化产物为___________、___________。该条件下还可以得到的副产物为NaAlO2和Na2SiO3,写出生成Na2SiO3的化学方程式为__________。
(3)滤渣2的主要成分为____________;滤渣4的主要成分为___________。
(4)调节pH3的合适试剂为_______________;调节pH3的范围为____________。
(5)用醋酸调节pH2=5的目的为________________。
(6)检验滤液4中Fe3+是否沉淀完全的方法是___________________________。
【题目】用如图所示装置制取表中的四种干燥、纯净的气体![]() 图中加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂。上述方法中可以得到干燥、纯净的气体是( )
图中加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂。上述方法中可以得到干燥、纯净的气体是( )
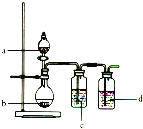
气体 | a | b | c | d |
| 稀盐酸 |
| 饱和 | 浓 |
| 浓盐酸 |
| NaOH溶液 | 浓 |
| 稀 | Cu | 品红溶液浓 |
|
| 稀盐酸 | 锌粒 | NaOH溶液 | 浓 |
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()