题目内容
【题目】碳酸锰(MnCO3)是制造电信器材的软磁铁氧体,也用作脱硫的催化剂,瓷釉、涂料和清漆的颜料。工业上利用软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质)制取碳酸锰的流程如下图所示:
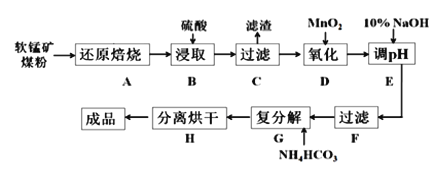
已知:还原焙烧主反应为:2MnO2+C![]() 2MnO+CO2↑。
2MnO+CO2↑。
可能用到的数据如下:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Mn(OH)2 |
开始沉淀pH | 1.5 | 6.5 | 4.2 | 8.3 |
沉淀完全pH | 3.7 | 9.7 | 7.4 | 9.8 |
根据要求回答下列问题:
(1)步骤B中若采用质量分数为35%的硫酸(密度ρ=1.26 g/cm3),则其物质的量浓度为____。
(2)步骤C中得到的滤渣主要成分是______________________________,步骤D中还原剂与氧化剂的物质的量之比为_____________________________。
(3)步骤E中调节pH的范围为______________________________。
(4)步骤G的离子方程式为_________________________________________,若Mn2+沉淀完全时测得溶液中CO32-的浓度为2.2×10-6 mol/L,则Ksp(MnCO3)=___________。
(5)实验室可以用Na2S2O8溶液来检验Mn2+是否完全发生反应,原理为:____Mn2+ +____ S2O82- + _____H2O = __________________________________,
①请完成上述离子方程式; _____________
②请描述Mn2+未完全反应时出现的现象__________。
【答案】4.5 mol/L CaSO4和Cu 2:1 大于3.7小于8.3 Mn2++2HCO3-=MnCO3↓+CO2↑+H2O Ksp(MnCO3)=2.2×10-11 2Mn2++5S2O82-+8H2O=16H++10SO42-+2MnO4- 无色变紫红色
【解析】
软锰矿主要成分为MnO2,还含有CaCO3、Fe2O3、Al2O3等杂质,还原焙烧主反应为:2MnO2+C═2MnO+CO2↑,加入硫酸酸浸过滤后的溶液中加入二氧化锰氧化亚铁离子,加入10%的氢氧化钠溶液调节溶液PH4.5使铁离子全部沉淀,过滤后的滤液中加入Na2S沉淀重金属离子可以除去Pb2+、Al3+等离子,滤液中加入碳铵发生复分解反应生成碳酸锰,分离烘干得到成品。
(1)步骤B中若采用质量分数为35%的硫酸(密度ρ=1.26 g/cm3),则其物质的量浓度为![]() =4.5 mol/L,故答案为:4.5 mol/L;
=4.5 mol/L,故答案为:4.5 mol/L;
(2)步骤C中得到的滤渣是不溶于水的Cu和微溶的CaSO4,步骤D中加入MnO2氧化溶液中的Fe2+,其中Mn从+4价降为+2价,Fe从+2价升高为+3价,Fe2+是还原剂,根据电子守恒,还原剂与氧化剂的物质的量之比为2:1,故答案为:CaSO4和Cu;2:1;
(3)由图表可知为了使Fe3+转化为Fe(OH)3而除去,而不影响Mn2+,步骤E中调节pH的范围为大于3.7小于8.3,故答案为:大于3.7小于8.3;
(4)在含有Mn2+的溶液中加入碳酸氢铵生成MnCO3沉淀,发生反应的离子方程式为Mn2++2HCO3-=MnCO3↓+CO2↑+H2O,若Mn2+沉淀完全时其浓度为1×10-5mol/L,溶液中CO32-的浓度为2.2×10-6 mol/L,则Ksp(MnCO3)=c(1×10-5mol/L)×c(2.2×10-6)=2.2×10-11,故答案为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O;Ksp(MnCO3)=2.2×10-11;
(5)实验室可以用Na2S2O8溶液来检验Mn2+是否完全发生反应,原理为:Mn2++S2O82-+H2O=H++SO42-+MnO4-。
①Mn2++S2O82-+H2O=H++SO42-+MnO4-中Mn从+2价升高为+7价,S从+7价降为+6价,根据电子守恒,Mn2+前系数为2,S2O82-前系数为5,再结合电荷守恒和原子守恒得此反应的离子方程式2Mn2++5S2O82-+8H2O=16H++10SO42-+2MnO4-,故答案为:2Mn2++5S2O82-+8H2O=16H++10SO42-+2MnO4-;
②取少量试样于试管中,滴入Na2S2O8溶液,溶液不变为紫色,可确认Mn2+离子已经完全反应,故答案为:无色变紫红色。

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案【题目】某化学反应2A(g) ![]() B(g) + D(g)在四种不同的条件下进行,B、D起始浓度为0,反应物A的浓度随反应时间的变化情况如下表:
B(g) + D(g)在四种不同的条件下进行,B、D起始浓度为0,反应物A的浓度随反应时间的变化情况如下表:
实验序号 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
(1) | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
(2) | 800 | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
(3) | 800 | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
(4) | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,下列说法错误的是
A. 在(1)中,反应在10~20 min内A的平均速率为0.013 mol/(L·min)
B. 在(2)中,A的初始浓度c2<1.0 mol/L
C. 设(3)的反应速率为υ3,(1)的反应速率为υ1,则υ3 > υ1
D. 比较(1)和(4),可推测该反应的正反应是吸热反应
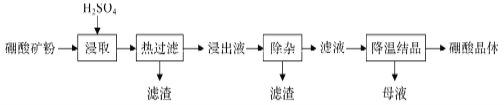
【题目】以硼镁矿(2MgO·B2O3·H2O、SiO2及少量Fe3O4、CaCO3、A12O3)为原料生产硼酸的工艺流程如下:
已知:表一:不同温度下H3BO3的溶解度
温度℃) | 20 | 40 | 60 | 100 |
溶解度(g) | 5.0 | 8.7 | 14.8 | 40.2 |
表二:不同物质沉淀完全时的pH
物质 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
pH | 3.2 | 5.2 | 9.7 | 12.4 |
(1)由于矿粉中含CaCO3,“浸取”时容易产生大量泡沫使物料从反应器中溢出,应采取的措施为_________________________。
(2)“浸出液”显酸性,含有H3BO3、Mg2+和SO42-,还含有Fe2+、Fe3+、Ca2+、Al3+等杂质。“除杂”时,向浸出液中依次加入适量H2O2和MgO,可以除去的杂质离子为_______________________,H2O2的作用为_____________________(用离子方程式表示)。
(3)“浸取”后,采用“热过滤”的目的为__________________________。
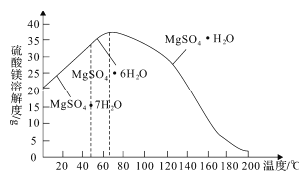
(4)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如图所示,且溶液的沸点随压强增大而升高。为了从“母液”中充分回收MgSO4·H2O,应采取的措施是将“母液”蒸发浓缩,____________________________________。
(5)己知25℃时,硼酸(H3BO3)溶液中存在如下平衡:H3BO3![]() [B(OH)4]-(aq)+H+(aq);K=5.7×10-10;25℃时,0.7mol·L-1硼酸溶液中c(H+)=__________mol·L-1。
[B(OH)4]-(aq)+H+(aq);K=5.7×10-10;25℃时,0.7mol·L-1硼酸溶液中c(H+)=__________mol·L-1。
(6)已知25℃时:
化学式 | H2CO3 | CH3COOH |
电离常数 | K1=4.4×10-7 K2=4.7×10-11 | K=1.75×10-5 |
下列说法正确的是________(填选项字母)。
a.碳酸钠溶液滴入硼酸溶液中能观察到有气泡产生
b.碳酸钠溶液滴入醋酸溶液中能观察到有气泡产生
c.等浓度碳酸溶液和硼酸溶液的pH:前者>后者
d.等浓度碳酸钠溶液和醋酸钠溶液的pH:前者>后者