题目内容
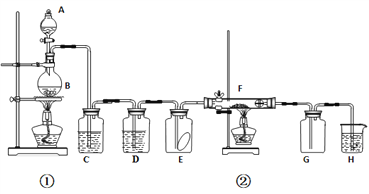
【题目】某化学实验小组的同学为了探究SO2和氯水的漂白性,设计了如图所示实验装置。

(1)写出A中反应的化学方程式:___________, 浓硫酸表现出_____性。
(2)实验室用装置E制备Cl2,离子方程式为____________。该反应中的还原剂是_______(填化学式)。
(3)①装置A和E中,常用于萃取操作的仪器是__________(填名称)。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B.______,D._____。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入品红溶液中,结果发现品红溶液未褪色,并且生成了两种常见的强酸,请你分析该现象的原因:__________(用化学方程式表示)。
【答案】 Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O 氧化性和酸性 MnO2+4H++2C1-
CuSO4+SO2↑+2H2O 氧化性和酸性 MnO2+4H++2C1-![]() Mn2++Cl2↑+2H2O HCl 分液漏斗 褪色的品红恢复红色 无明显现象 Cl2+SO2+2H2O=2HCl+ H2SO4
Mn2++Cl2↑+2H2O HCl 分液漏斗 褪色的品红恢复红色 无明显现象 Cl2+SO2+2H2O=2HCl+ H2SO4
【解析】(1)装置A中浓硫酸与铜在加热条件下反应生成硫酸铜、二氧化硫和水,反应的化学方程式为: Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O, 浓硫酸中硫元素部分化合价由+6价变为+4价,部分化合价不变以硫酸盐形式存在,表现出氧化性和酸性;(2)实验室用装置E二氧化锰和浓盐酸反应制备Cl2,离子方程式为MnO2+4H++2C1-
CuSO4+SO2↑+2H2O, 浓硫酸中硫元素部分化合价由+6价变为+4价,部分化合价不变以硫酸盐形式存在,表现出氧化性和酸性;(2)实验室用装置E二氧化锰和浓盐酸反应制备Cl2,离子方程式为MnO2+4H++2C1-![]() Mn2++Cl2↑+2H2O;该反应中盐酸中的氯元素由-1价变为0价,作为还原剂,故还原剂为HCl;(3)①装置A和E中,常用于萃取操作的仪器是分液漏斗;②二氧化硫漂白后的物质具有不稳定性,加热时又能变为红色,而氯气的漂白具有不可逆性,加热也不能恢复红色,故停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B. 褪色的品红恢复红色,D. 无明显现象;(4) SO2和Cl2按1:1通入,SO2和Cl2恰好反应,二者反应生成H2SO4和HCl,发生Cl2+SO2+2H2O=2HCl+H2SO4,不再具有漂白性。
Mn2++Cl2↑+2H2O;该反应中盐酸中的氯元素由-1价变为0价,作为还原剂,故还原剂为HCl;(3)①装置A和E中,常用于萃取操作的仪器是分液漏斗;②二氧化硫漂白后的物质具有不稳定性,加热时又能变为红色,而氯气的漂白具有不可逆性,加热也不能恢复红色,故停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B. 褪色的品红恢复红色,D. 无明显现象;(4) SO2和Cl2按1:1通入,SO2和Cl2恰好反应,二者反应生成H2SO4和HCl,发生Cl2+SO2+2H2O=2HCl+H2SO4,不再具有漂白性。