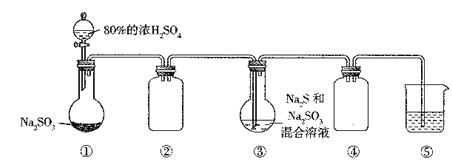
题目内容
【题目】硫氧化物易引起环境行染,需要悉心研究。
(1)二氧化硫可用于催化氧化制硫酸。硫酸工业中,作为催化剂的V2O5对反应I的催化循环过程经历了Ⅱ、Ⅲ两个反应阶段,如图所示:

下列分子中1mol化学键断裂时需要吸收的能量数据如下:
化学键 | S=O(SO2) | S=O(SO3) | O=O(O2) |
能量/kJ | 535 | a | 496 |
反应Ⅰ的△H=-98 kJ ·mol-1,则 a=____________。反应Ⅲ的化学方程式为______________。将2molSO2和1molO2充入密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g)![]() 2SO3(g)。平衡时SO3的体积分数(% )随温度和压强的变化如表所示:下列判断正确的是(_____________)
2SO3(g)。平衡时SO3的体积分数(% )随温度和压强的变化如表所示:下列判断正确的是(_____________)
压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
350 | 5.0 | a | b |
415 | c | 40.0 | d |
550 | e | f | 36.0 |
A.b >e
B.415℃、2.0MPa时O2的转化率为60%
C.在一定温度和压强下,加入V2O5作催化剂能加快反应速率,提高SO3的体积分数
D.平衡常数K(550℃)>K(350℃)
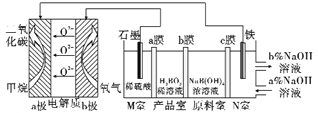
(2)较纯的SO2,可用于原电池法生产硫酸。图中离子交换膜是________离子交换膜(填“阴”、“阳”)。

(3)研究发现,含碱式硫酸铝的溶液与SO2结合的方式有2种:其一是与溶液中的水结合。其二是与碱式硫酸铝中的活性Al2O3结合,通过酸度计测定吸收液的pH变化,结果如右图所示:

请解释曲线如图变化的原因_______________________________。
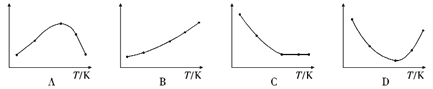
(4)取五等份SO3,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:3SO3(g)![]() (SO3)3(g) △H<0,反应相同时间后,分别测定体系中SO3的百分含量,并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是(_____)
(SO3)3(g) △H<0,反应相同时间后,分别测定体系中SO3的百分含量,并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是(_____)
(5)用Na2SO3溶液作为吸收液吸收SO2时,产物为NaHSO3,已知亚硫酸的两级电离平衡常数分别为Ka1、Ka2。则常温下NaHSO3溶液显酸性的充要条件为_____________。(用含为Ka1、Ka2的代数式表示)
【答案】 472 2V2O4·SO3+O2=2V2O5+2SO3 A 阳 二氧化硫先与活性氧化铝结合成亚硫酸铝,水解显酸性。后与水结合生成亚硫酸,电离显酸性。电离强于水解 BD Ka1·Ka2>10-14
【解析】(1)反应热等于反应物的总键能减生成物的总键能,反应I的热化学反应方程式为SO2(g)+ ![]() O2(g)=SO3(g)△H=-98 kJ ·mol-1,则反应I的△H=(2×535+
O2(g)=SO3(g)△H=-98 kJ ·mol-1,则反应I的△H=(2×535+![]() ×496-3×a)kJ/mol=-98kJ/mol,解得a=472 kJ ·mol-1,V2O5在反应中作催化剂,反应Ⅱ生成V2O4SO3,V2O5参加反应,方程式为SO2+V2O5V2O4SO3,反应Ⅲ是V2O4SO3与氧气反应生成V2O5和SO3反应Ⅱ生成V2O4SO3,方程式为2V2O4SO3+O22V2O5+2SO3,A.该反应是气体体积减小的反应,加压平衡右移,C的体积分数增加,则b>54.0%,e<36.0%,所以b>e,A正确;B.在一定条件下发生反应
×496-3×a)kJ/mol=-98kJ/mol,解得a=472 kJ ·mol-1,V2O5在反应中作催化剂,反应Ⅱ生成V2O4SO3,V2O5参加反应,方程式为SO2+V2O5V2O4SO3,反应Ⅲ是V2O4SO3与氧气反应生成V2O5和SO3反应Ⅱ生成V2O4SO3,方程式为2V2O4SO3+O22V2O5+2SO3,A.该反应是气体体积减小的反应,加压平衡右移,C的体积分数增加,则b>54.0%,e<36.0%,所以b>e,A正确;B.在一定条件下发生反应
2A(g)+B(g)2C(g)
起始(mol) 2 1 0
转化(mol) 2x x 2x
平衡(mol) 2-2x x 2x
C的体积分数为40%,则: ![]() ×100%=40%,解得:x=0.5mol,所以B的转化率为:
×100%=40%,解得:x=0.5mol,所以B的转化率为: ![]() ×100%=50%,故B错误;C.在一定温度和压强下,加入V2O5作催化剂能加快反应速率,但平衡不移动,SO3的体积分数不变,故C错误;D.该反应为放热反应,升温平衡左移,平衡常数减小,则K(550℃)<K(350℃),故D错误;故选A;故答案为:472;2V2O4SO3+O22V2O5+2SO3;A;
×100%=50%,故B错误;C.在一定温度和压强下,加入V2O5作催化剂能加快反应速率,但平衡不移动,SO3的体积分数不变,故C错误;D.该反应为放热反应,升温平衡左移,平衡常数减小,则K(550℃)<K(350℃),故D错误;故选A;故答案为:472;2V2O4SO3+O22V2O5+2SO3;A;
(2)根据图示,通入二氧化硫的电极为负极,二氧化硫失去电子生成硫酸根离子,SO2-2 e--+2H2O = SO42-+ 4H+,通入空气的电极为正极,空气中的氧气得到电子生成水,O2 + 4e-- + 4H+ == 2H2O,氢离子通过阳离子交换膜进入正极区,故答案为:阳;
(3) 二氧化硫先与活性氧化铝结合成亚硫酸铝,水解显酸性,溶液的pH变化较小,后与水结合生成亚硫酸,电离显酸性,电离强于水解,溶液的pH变化较快,故答案为:二氧化硫先与活性氧化铝结合成亚硫酸铝,水解显酸性,后与水结合生成亚硫酸,电离显酸性,电离强于水
(4)①A、因为该反应是放热反应,温度越高,平衡向逆反应方向移动,SO3的百分含量随温度升高而升高,故A错误;B、因为该反应是放热反应,温度越高,平衡向逆反应方向移动,SO3的百分含量随温度升高而升高,故B正确;C、若5个容器中有未达到平衡状态的,那么温度越高,反应速率越大,会出现温度高的SO3转化得快,导致SO3的百分含量少的情况,不可能出现SO3的百分含量不变的情况,故C错误;D、在D图中转折点为平衡状态,转折点左侧为未平衡状态,右侧为平衡状态,反应是放热反应,温度升高,平衡向逆反应方向移动,SO3的百分含量随温度升高而升高,故D正确;故选BD;
(5) NaHSO3溶液中存在HSO3-![]() H++SO32-的电离平衡常数为Ka2,也存在HCO3-+H2O
H++SO32-的电离平衡常数为Ka2,也存在HCO3-+H2O ![]() H2CO3+OH-,水解平衡常数为
H2CO3+OH-,水解平衡常数为![]() ,常温下NaHSO3溶液显酸性的充要条件为Ka2>
,常温下NaHSO3溶液显酸性的充要条件为Ka2>![]() ,即Ka1·Ka2>10-14,故答案为:Ka1·Ka2>10-14。
,即Ka1·Ka2>10-14,故答案为:Ka1·Ka2>10-14。