题目内容
已知298K时, N2(g)+3H2(g)=2 NH3(g);△H=-92.4kJ/mol, 在相同条件下,向密闭容器中加入1molN2和3molH2,达到平衡时放出的热量为Q1,向另一容积相同的密闭容器中通入0.95molN2、2.85molH2和0.1molNH3,达到平衡时放出的热量为Q2,则下列关系式正确的是
A.Q1 = Q2 = 92.4kJ B.Q2 < Q1 = 92.4kJ
C.Q2< Q1< 92.4kJ D..Q2 = Q1 < 92.4kJ
C

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案(14分).下表是部分短周期元素的原子半径及主要化合价:
| 元素代号 | W | R | X | Y | Z | Q | M |
| 原子半径/nm | 0.037 | 0.186 | 0.074 | 0.075 | 0.077 | 0.110 | 0.160 |
| 主要化合价 | +1 | +1 | -2 | -3,+5 | +2,+4 | -3,+5 | +2 |
试回答下列问题:
(1)七种元素中原子半径最大的元素在周期表中位置是 。M在Z的最高价氧化物中燃烧的化学方程式为 。
(2) 元素Z可形成多种同素异形体,其中有属于原子晶体的, 写出它的名称
(3)X可与R按1:l的原子个数比形成离子化合物甲,甲中存在的化学键有 ;X可与w组成含18电子的共价化合物乙,则乙的电子式为 。
(4)M的最高价氧化物的水化物难溶于水,已知298K时,该物质的的KSP=5.6×10-12,若此时测得溶液pH=13.00,则此温度下残留在溶液中的M离子物质的量浓度为 mol·L-1。
(5)向含4mol Y的最高价氧化物对应的水化物的稀溶液中,逐渐加入铁粉末至过量。假设生成的气体只有一种,请在坐标系中画出n(Fe2+)随n(Fe )变化的示意图,并标出n(Fe 2+)的最大值。
(14分).下表是部分短周期元素的原子半径及主要化合价:
|
元素代号 |
W |
R |
X |
Y |
Z |
Q |
M |
|
原子半径/nm |
0.037 |
0.186 |
0.074 |
0.075 |
0.077 |
0.110 |
0.160 |
|
主要化合价 |
+1 |
+1 |
-2 |
-3,+5 |
+2,+4 |
-3,+5 |
+2 |
试回答下列问题:
(1)七种元素中原子半径最大的元素在周期表中位置是 。M在Z的最高价氧化物中燃烧的化学方程式为 。
(2) 元素Z可形成多种同素异形体,其中有属于原子晶体的, 写出它的名称
(3)X可与R按1:l的原子个数比形成离子化合物甲,甲中存在的化学键有 ;X可与w组成含18电子的共价化合物乙,则乙的电子式为 。
(4)M的最高价氧化物的水化物难溶于水,已知298K时,该物质的的KSP=5.6×10-12,若此时测得溶液pH=13.00,则此温度下残留在溶液中的M离子物质的量浓度为 mol·L-1。
(5)向含4mol Y的最高价氧化物对应的水化物的稀溶液中,逐渐加入铁粉末至过量。假设生成的气体只有一种,请在坐标系中画出n(Fe2+)随n(Fe )变化的示意图,并标出n(Fe 2+)的最大值。

对于一个化学反应的研究需要从反应条件、限度、速率、定量关系等因素进行综合分析,下列是关于化学反应的系列研究,请根据相关信息回答问题。
⑴关于反应物之间的定量关系的研究:
已知反应:Br2 +2Fe2+=2 Br -+2Fe3+,向10 mL0 .1mol/L的Fe Br2溶液中通入0 .003mol Cl2,该反应的离子方程式为
⑵关于反应速率、限度的研究:
①已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,在氯化镁溶液中加入一定量的烧碱,测得pH=13.0,则此温度下残留在溶液中的c(Mg 2+)=
②科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂。
一定温度下,在2L密闭容器中加入纳米级的Cu2O并通入0 .1mol水蒸气,发生反应:
 2 H2O(g)
2 H2O(g)
2 H2 (g) + O2(g) △H=+484kJ· mol-1,不同时段产生O2的量见下表:
|
时间/min |
20 |
40 |
60 |
80 |
|
n(O2)/mol |
0.0010 |
0.0016 |
0.0020 |
0.0020 |
则前20min的反应速率v(H2O)= ;达到平衡时,至少需要吸收的光能为 kJ。
③向某密闭容器中加入0 .3molA、0 .1molC和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如下图中甲图所示。附图中乙图为t2时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且四个阶段都只改变一种条件。已知t3~t4为使用催化剂,甲图中t0~t1阶段c (B)未画出。请回答:

Ⅰ:t4~t5阶段改变的条件是 t5~t6阶段改变的条件是
Ⅱ:B的起始浓度为 ,该反应方程式为
(08山东省威海市质检)(8分)I.(1)已知298K时2C(s)+O2(g)=2CO(g) △H1=-221.01kJ?mol-1
C(s)+O2(g)=CO2(g) △H2=-393.5kJ?mol-1 则298K时CO(g)在O2(g)燃烧生成CO2(g) 的热化学反应方程式为:________。
(2)一种新型的熔融盐燃料电池具有高发电效率而备受重视。现用Li2CO3和Na2CO3的熔融盐混合物做电解质,一极通入CO气体,另一极通入空气与CO2的混合气体,制得燃料电池。
该电池工作时的负极反应式为: ;
熔融盐中CO32-的物质的量在工作时 (填“增大”、“减少”、“不变”)。
|
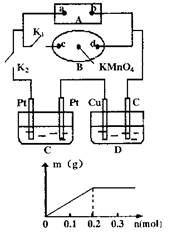
II.如右图所示,A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D
为电解槽,其电极材料及电解质溶液见图。
(1)关闭K1,打开K2,通电后,B的KMnO4紫红色液滴向c端移动,则电源a端为 极,通电一段时间后,观察到滤纸d端出现的现象是: ;
(2)已知C装置中溶液为Cu(NO3)2和X(NO3)3,且均为0.1mol,打开K1,关闭K2,通电一段时间后,阴极析出固体质量m(g)与通过电子的物质的量n(mol)关系如图所示。则Cu2+、X3+、H+氧化能力由大到小的顺序是 ;D装置Cu极的电极反应式为 。