题目内容
【题目】某化学实验小组的同学为探究和比较SO2和氯水漂白性的强弱,设计了如下的实验装置。
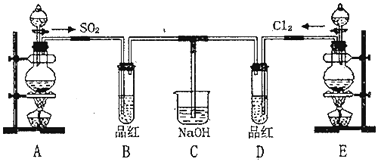
(1)实验室用装置A制备SO2.某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是_____
(2)实验室用装置E制备Cl2,写出反应的化学方程式_____请指出该反应中的液体反应物在反应中所表现出的化学性质_____。若液体反应物中的溶质反应了6mol,则标准状况下生成Cl2的体积为_____L
(3)停止通气后,再给BD两个试管分别加热,两个试管中的现象分别为:B_____、D_____
(4)C装置的作用是吸收尾气,防止污染空气,写出吸收Cl2的离子方程式_____
(5)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通到品红溶液中,结果发现溶液基本不褪色。请你分析该现象的原因_____(用化学方程式表示)
【答案】分液漏斗的玻璃塞没有取下来 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 酸性和还原性 33.6 褪色的品红又恢复成红色 溶液没有明显变化 Cl2+2OH-=Cl-+ClO-+H2O Cl2+SO2+2H2O=2HCl+H2SO4
MnCl2+Cl2↑+2H2O 酸性和还原性 33.6 褪色的品红又恢复成红色 溶液没有明显变化 Cl2+2OH-=Cl-+ClO-+H2O Cl2+SO2+2H2O=2HCl+H2SO4
【解析】
A用于制备SO2,可用Na2SO3与硫酸反应制取,B用于检验二氧化硫的生成,E用浓盐酸和二氧化锰在加热条件下MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O制备氯气,D用于检验气体的漂白性,C用于吸收尾气。
MnCl2+Cl2↑+2H2O制备氯气,D用于检验气体的漂白性,C用于吸收尾气。
(1)塞子没有取下来,打开活塞时,空气无法进入分液漏斗内部,从而造成分液漏斗内的压强小于大气压强。
(2)实验室中用二氧化锰固体与浓盐酸加热反应制备氯气,方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,反应中HCl被氧化生成Cl2,表现出还原性;反应生成盐,表现出酸性。由方程式可知,6molHCl参加反应生成氯气:6mol×
MnCl2+Cl2↑+2H2O,反应中HCl被氧化生成Cl2,表现出还原性;反应生成盐,表现出酸性。由方程式可知,6molHCl参加反应生成氯气:6mol×![]() =1.5mol,则生成的氯气的体积为1.5mol×22.4L/mol。
=1.5mol,则生成的氯气的体积为1.5mol×22.4L/mol。
(3)次氯酸的漂白性是永久性的,加热也不会改变反应产物;二氧化硫的漂白是暂时的,加热时,无色的产物会分解,又生成原来的反应物。
(4)用氢氧化钠溶液吸收氯气,生成氯化钠、次氯酸钠和水。
(5)氯气具有较强的氧化性,二氧化硫具有较强的还原性,在水溶液中两者1:1发生反应生成没有漂白性的产物。
(1)塞子没有取下来,打开活塞时,空气无法进入分液漏斗内部,造成分液漏斗内的压强小于大气压强,液体无法流出。答案为:分液漏斗的玻璃塞没有取下来;
(2)实验室中用二氧化锰固体与浓盐酸加热反应制备氯气,反应的方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,反应中HCl被氧化表现还原性,同时生成盐表现酸性;由方程式可知,6molHCl参加反应生成氯气:6mol×
MnCl2+Cl2↑+2H2O,反应中HCl被氧化表现还原性,同时生成盐表现酸性;由方程式可知,6molHCl参加反应生成氯气:6mol×![]() =1.5mol,则生成的氯气的体积为1.5mol×22.4L/mol=33.6L。答案为:MnO2+4HCl(浓)
=1.5mol,则生成的氯气的体积为1.5mol×22.4L/mol=33.6L。答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;酸性和还原性;33.6;
MnCl2+Cl2↑+2H2O;酸性和还原性;33.6;
(3)次氯酸的漂白性是永久性的,二氧化硫的漂白性是暂时的。加热时,次氯酸漂白过的溶液无变化,二氧化硫和有色物质生成的无色物质不稳定,加热时会变成红色。答案为:褪色的品红又恢复成红色;溶液没有明显变化;
(4)用氢氧化钠溶液吸收氯气,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O。答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(5)氯气具有较强的氧化性,二氧化硫具有较强的还原性,在水溶液中两者1:1发生反应Cl2+SO2+2H2O=2HCl+H2SO4,生成物都无漂白性,因而SO2和Cl2按1:1同时通入到品红溶液时,品红溶液并不褪色。答案为:Cl2+SO2+2H2O=2HCl+H2SO4。

【题目】已知常温下浓度为0.1mol·L-1的下列溶液的pH如下表:
溶质 | NaF | NaClO | Na2CO3 |
pH | 7.5 | 9.7 | 11.6 |
下列有关说法正确的是
A. 在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF
B. 若将CO2通入0.1 mol·L-1Na2CO3溶液中至溶液中性,则溶液中2c(CO32-)+c(HCO3-)=0.1 mol·L-1
C. 根据上表,水解方程式ClO-+H2O![]() HClO+OH-的水解常数K=10-7.6
HClO+OH-的水解常数K=10-7.6
D. 向上述NaClO溶液中通HF气体至恰好完全反应时:c(Na+)>c(F-)>c(H+)>c(HClO)>c(OH-)