题目内容
【题目】下列图中的实验方案, 能达到实验目的的是( )
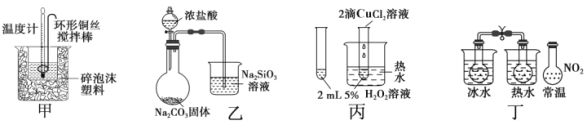
A.图甲:进行中和热的测定
B.图乙:比较 HCl、H2CO3和 H2SiO3 的酸性强弱
C.图丙:验证 CuCl2对 H2O2 分解有催化作用
D.图丁:验证 2NO2(g)![]() N2O4 (g) △H<0
N2O4 (g) △H<0
【答案】D
【解析】
试题分析:A.进行中和热的测定是要尽量减少热量损失,所以不能用铜丝搅拌,应选用玻璃棒,故A错误;B.由于盐酸具有挥发性,所以图乙不能用来比较 HCl、 H2CO3和 H2SiO3 的酸性强弱,故B错误;C.由于两试管中反应物的温度不同,所以不能用图丙装置验证 CuCl2对 H2O2 分解有催化作用,故C错误;D.图丁可以用来验证温度对平衡 2NO2(g)![]() N2O4 (g) △H<0的影响,故D正确。故选D。
N2O4 (g) △H<0的影响,故D正确。故选D。

 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案【题目】右表是元素周期表的一部分,其中A、B、D、E、G、J为短周期元素,G元素的核电荷数为B元素的2倍。请回答下列问题:
A | B | ||
D | E | G | J |
L | M | Q |
(1)J的最高价氧化物对应水化物的化学式是___________________。
(2)G2J2常用作橡胶的低温硫化剂和黏结剂,其电子式为_______________________。写出一个能表示元素G、J非金属性强弱关系的化学方程式____________________________。
(3)G单质在空气中燃烧生成一种无色有刺激性气味的气体,该无色有刺激性气味的气体与含1molJ的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在—定条件下反应,可生成一种强酸和一种氧化物,且该反应中有NA个电子转移,则该反应的化学方程式是________________________。
(4)A的最简单氢化物是___________(填“极性”或“非极性”)分子,实验室制备该物质的化学方程式为__________________________________________。
(5)根据元素周期律,可以推测上表中长周期元素的单质具有半导体特性的是__________(填元素符号)。