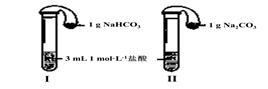题目内容
将0.01 mol下列物质分别加入100 mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度的大小顺序是(溶液体积变化忽略不计)
①Na2O2 ②Na2O ③Na2CO3 ④NaCl
①Na2O2 ②Na2O ③Na2CO3 ④NaCl
| A.①>②>③>④ | B.①>②>④>③ |
| C.①=②>③>④ | D.①=②>③=④ |
C
0.01 mol Na2O2、Na2O与水反应的方程式分别为Na2O2+H2O=2NaOH+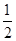 O2↑、Na2O+H2O=2NaOH,二者均产生0.02 mol OH-,因溶液体积变化忽略不计,故所得溶液中阴离子浓度:①=②;Na2CO3和NaCl电离产生的阴离子均为0.01 mol,而CO32—发生微弱的水解:CO+H2O
O2↑、Na2O+H2O=2NaOH,二者均产生0.02 mol OH-,因溶液体积变化忽略不计,故所得溶液中阴离子浓度:①=②;Na2CO3和NaCl电离产生的阴离子均为0.01 mol,而CO32—发生微弱的水解:CO+H2O HCO+OH-,使阴离子数目增多,所得溶液中阴离子浓度:③>④。
HCO+OH-,使阴离子数目增多,所得溶液中阴离子浓度:③>④。
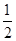 O2↑、Na2O+H2O=2NaOH,二者均产生0.02 mol OH-,因溶液体积变化忽略不计,故所得溶液中阴离子浓度:①=②;Na2CO3和NaCl电离产生的阴离子均为0.01 mol,而CO32—发生微弱的水解:CO+H2O
O2↑、Na2O+H2O=2NaOH,二者均产生0.02 mol OH-,因溶液体积变化忽略不计,故所得溶液中阴离子浓度:①=②;Na2CO3和NaCl电离产生的阴离子均为0.01 mol,而CO32—发生微弱的水解:CO+H2O HCO+OH-,使阴离子数目增多,所得溶液中阴离子浓度:③>④。
HCO+OH-,使阴离子数目增多,所得溶液中阴离子浓度:③>④。
练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目