题目内容
实验室制取少量N2,常利用的反应是:NaNO2+NH4Cl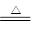 NaCl+N2↑+2H2O,关于该反应的说法正确的是
NaCl+N2↑+2H2O,关于该反应的说法正确的是
| A.NaNO2是氧化剂,发生还原反应 |
| B.生成1mol N2时转移的电子数为6mol |
| C.NH4Cl中的N元素被还原 |
| D.N2既是氧化剂又是还原剂 |
A
解析试题分析:A、正确;B、生成1mol N2时转移的电子数为3mol,错误;C、NH4Cl中的N元素被氧化,错误;D、N2既是氧化产物又是还原产物,错误。
考点:氧化还原反应的有关概念。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
根据表中信息判断,下列选项不正确的是( )
| 序列 | 参加反应的物质 | 生成物 |
| ① | KMnO4 、H2O2 、H2SO4 | K2SO4 、MnSO4…… |
| ② | Cl2 、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4- …… | Cl2 、Mn2+ …… |
A.第①组反应的其余产物为H2O和O2
B.第②组反应中Cl2 与 FeBr2的物质的量之比为1︰2
C.第③组反应中生成1mol Cl2,转移电子2mol
D.氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Br2
氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用不相同的是( )
| A.2Na2O2+2H2O=4NaOH+O2↑ | B.Cl2+H2O  HClO+HCl HClO+HCl |
| C.2F2+2H2O=4HF+O2 | D.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
需要加入适当的氧化剂才能实现的反应
| A.PCl3→PCl5 | B.MnO4-→Mn2+ | C.SO3→SO42- | D.CO2→CO32- |
某溶液中阳离子只含K+,其中Cl-、Br-、I-的个数比为1∶2∶3,欲使这些离子个数比变为3∶2∶1,需要通入的氯分子与原溶液中I-的个数比应为( )
| A.1∶2 | B.2∶1 | C.1∶3 | D.3∶1 |
氧化还原反应与四种基本反应类型的关系如下图所示,则下列化学反应属于丙区域的是( )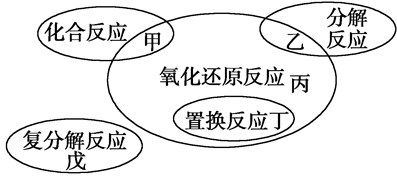
| A.Cl2+2KBr=Br2+2KCl | B.2NaHCO3 Na2CO3+H2O+CO2↑ Na2CO3+H2O+CO2↑ |
C.3Mg+N2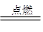 Mg3N2 Mg3N2 | D.2Na2O2+2CO2=2Na2CO3+O2 |
下列有关氧化还原反应的叙述正确的是( )
| A.物质所含元素化合价降低的反应是还原反应 |
| B.金属原子越容易失去电子,其氧化性越强 |
| C.某元素由化合态转化为游离态,该元素一定被氧化 |
| D.金属单质在氧化还原反应中只能作还原剂,非金属单质只能作氧化剂 |
 MnCl2 + Cl2↑ + 2H2O。
MnCl2 + Cl2↑ + 2H2O。