题目内容
【题目】第ⅢA族的单质及一些化合物在工农业生产等领域有重要应用。回答下列问题:
(1)基态Ga原子价电子排布图为________.
(2)经测定发现,N2O5固体由NO2+和NO3-两种离子组成,该固体中N原子杂化类型为___;与NO2+互为等电子体的微粒有_____(写出一种)。
(3)铵盐大多不稳定,NH4F、NH4I中,较易分解的是_____,原因是______.
(4)第二周期中,第一电离能介于B元素和N元素之间的元素有______种。
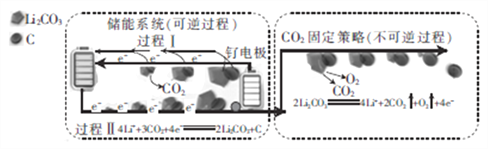
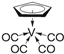
(5)晶体别有多种变体,但其基本结构单元都是由硼原子组成的正二十面体(见下图),每个顶点为一个硼原子,每个三角形均为等边三角形。若此结构单元为1个分子,则其分子式为____.

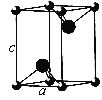
(6)冰晶石(Na3AlF6)由两种微粒构成,冰晶石的晶胞结构如图甲所示,●位于大立方体的顶点和面心,ο位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是_________ (填微粒符号)。
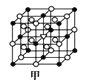
(7)A1单质的晶体中原子的堆积方式如图乙所示,其晶跑特征如图丙所示,原子之间相互位置关系的平面图如图丁所示:

若己知Al的原子半径为dnm,NA代表阿伏加德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目_____个;Al晶体的密度为_____g/cm3(用字母表示)。
【答案】 ![]() sp、sp2( SCN-、CO2、CS2、N3-等中的任一种 NH4F F原子半径比I原子小,H-F键比H-I键强(或H-F更易形成易夺取NH4+中的H+) 3 B12 Na+ 4 M×1021/[4
sp、sp2( SCN-、CO2、CS2、N3-等中的任一种 NH4F F原子半径比I原子小,H-F键比H-I键强(或H-F更易形成易夺取NH4+中的H+) 3 B12 Na+ 4 M×1021/[4![]() NA]
NA]
【解析】Ga原子核电荷数为31,核外电子排布1s22s22p63s23p63d104s24p1;基态Ga原子价电
子排布图为![]() ;正确答案:
;正确答案:![]() 。
。
(2) NO2+其中心N原子价电子对数=σ键个数+孤电子对个数=2+(5-1-2×2)/2=2,所以其中的氮原子按sp方式杂化;NO3-价层电子对数为=3+(5+1-2×3)=3,属于sp2杂化;等电子体是指原子数相等,电子总数相等的微粒,因此原子数为3,电子数为22的等电子微粒有(和NO2+):SCN-、CO2、CS2、N3-等中的任一种;正确答案: sp、sp2; SCN-、CO2、CS2、N3-等中的任一种。
(3) 由于F原子半径比I原子小,H-F键比H-I键强(或H-F更易形成易夺取NH4+中的H+),所以NH4F、NH4I中,较易分解的是NH4F;正确答案:NH4F;F原子半径比I原子小,H-F键比H-I键强(或H-F更易形成易夺取NH4+中的H+)。
(4) 同周期元素第一电离能从左到右有增大的趋势,特例是ⅡA的第一电离能大于ⅢA,ⅤA的第一电离能大于ⅥA,故第一电离能介于B元素和N元素的元素有Be、C、O,共计3种;正确答案:3。
(5) 根据晶胞的结构图可以知道,每个硼原子被5个正三角形共用,每个正三角形上有三个硼原子,所以这个基本结构单元含有硼原子的个数为:(20×3)/5=12;若此结构单元为1个分子,则其分子式为B12;正确答案:B12。
(6)该晶胞中●个数=8×![]() +6×
+6×![]() =4,○个数=12×
=4,○个数=12×![]() +8=11,根据化学式知,冰晶石中阳离子和阴离子个数之比为3:1,要使阳离子、阴离子个数之比为3:1,则大立方体的体心处▽所代表的微粒是Na+;正确答案:Na+。
+8=11,根据化学式知,冰晶石中阳离子和阴离子个数之比为3:1,要使阳离子、阴离子个数之比为3:1,则大立方体的体心处▽所代表的微粒是Na+;正确答案:Na+。
(7) (1)根据乙图可知,Al为面心立方堆积,铝原子位于晶胞8个顶点和立方体的6个面心,一个晶胞中Al原子的数目N=1/8+1/2×6=4正确答案:4。
(2)设晶胞中立方体的边长为a,根据丙图中原子之间的位置关系有a2+a2=(4d)2,则a=2![]() nm,则晶胞的体积为V=a3=[2
nm,则晶胞的体积为V=a3=[2![]() 10-7]3cm3,一个晶胞中含有4个铝原子,则晶胞的质量为m=NM/NA ,密度ρ=m/V= NM/NAV,代入数据计算可得晶胞密度ρ=4×M/NAV×= M÷[4
10-7]3cm3,一个晶胞中含有4个铝原子,则晶胞的质量为m=NM/NA ,密度ρ=m/V= NM/NAV,代入数据计算可得晶胞密度ρ=4×M/NAV×= M÷[4![]() ×10-21×NA ] =M×1021/[4
×10-21×NA ] =M×1021/[4![]() NA];正确答案:M×1021/[4
NA];正确答案:M×1021/[4![]() NA]。
NA]。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列各组物质中,满足下图物质一步转化关系的选项是
选项 | X | Y | Z |
A | Na | Na2O2 | Na2CO3 |
B | Cu | CuCl2 | Cu(OH)2 |
C | Al | Al2O3 | Al(OH)3 |
D | Fe | FeCl3 | FeCl2 |
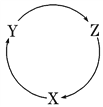
A. A B. B C. C D. D