题目内容
【题目】硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,另含少量杂质FeCO3和SiO2等)为原料制备高纯氧化镁的实验流程如下:

(1)MgCO3与稀硫酸反应的离子方程式是____________。
(2)加入H2O2氧化时,发生反应的离子方程式为____________________。
(3)煅烧过程存在以下反应:
2MgSO4+C![]() 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C![]() MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C![]() MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用下图装置对煅烧产生的气体进行分步吸收或收集。
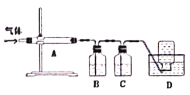
①A中现象是________,A中收集的物质可用热的NaOH溶液去除,写出该反应的化学反应方程式:__________________。
②B中盛放的溶液可以是_________(填字母)。
a.NaOH溶液 b.Na2CO3溶液 c.稀硝酸 d.品红溶液 e.酸性KMnO4溶液
③D中收集的气体可以是________(填化学式)。
【答案】MgCO3+2H+=Mg2++CO2↑+H2O 2Fe2++2H++H2O2=2Fe3++2H2O A中有淡黄色固体附着 3S +6NaOH =△ Na2SO3+ 2Na2S+3H2O e CO
【解析】
根据流程图及题干信息分析每步发生的化学反应,进而判断滤渣、滤液的成分,书写离子放出式;根据装置图及题干信息分析图中装置的作用及盛放的试剂。
(1)MgCO3与稀硫酸发生复分解反应生成硫酸镁、二氧化碳和水,离子方程式是MgCO3+2H+=Mg2++CO2↑+H2O,
故答案为:MgCO3+2H+=Mg2++CO2↑+H2O;
(2)滤液中含有亚铁离子,加入H2O2氧化时,亚铁离子被氧化,离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O,
故答案为: 2Fe2++2H++H2O2=2Fe3++2H2O;
(3)①根据题干信息知煅烧后生成黄色固体S,所以A中现象是有淡黄色固体附着;A中生成的物质有MgO和S,S与NaOH溶液反应的化学反应方程式:3S +6NaOH ![]() Na2SO3+ 2Na2S+3H2O;
Na2SO3+ 2Na2S+3H2O;
②煅烧产生的气体有二氧化硫、二氧化碳和一氧化碳,若进行分步吸收,则先利用二氧化硫的还原性用酸性高锰酸钾吸收,所以B中盛放的溶液可以是酸性高锰酸钾;
③产生气体中二氧化硫和二氧化碳被吸收,所以D中收集的气体可以是CO,
故答案为:A中有淡黄色固体附着;3S +6NaOH![]() Na2SO3+ 2Na2S+3H2O;e;CO。
Na2SO3+ 2Na2S+3H2O;e;CO。

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案