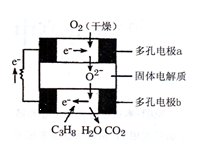
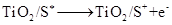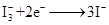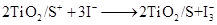题目内容
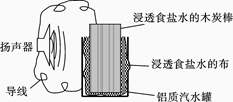
某同学设计的铜锌原电池如右图所示,则下列说法正确的是
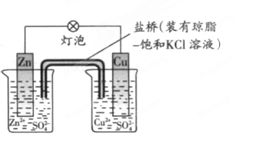

| A.因为锌与硫酸锌,铜与硫酸铜不反应,所以该装置无法工作 |
| B.电池反应为:Zn2++Cu=Zn +Cu2+ |
| C.盐桥中的Cl-移向ZnSO4溶液 |
| D.在外电路中,电流从负极流向正极 |
C
试题分析:A、构成原电池的条件是活泼性不同的金属,或金属与非金属,导线相连并插入到电解质溶液中。锌的金属性强于铜。因此根据装置可知,该装置是原电池,可以工作,A不正确;B、锌是负极,铜是正极,溶液中的铜离子得到电子,所以电池反应为Zn+Cu2+=Zn2++Cu,B不正确;C、原电池中负极失去电子,电子沿导线传递到正极。因此溶液中的阳离子向正极移动,则阴离子向负极移动,所以盐桥中的Cl-移向ZnSO4溶液,C正确;D、在外电路中,电流从正极流向负极,D不正确,答案选C。

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案
相关题目
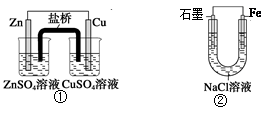
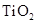 纳米晶体表面制成,另一电极由导电玻璃镀铂构成,电池中发生的反应为:
纳米晶体表面制成,另一电极由导电玻璃镀铂构成,电池中发生的反应为: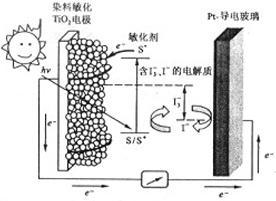
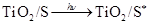 (激发态)
(激发态)