题目内容
下列分子或离子中,所有原子都满足最外层为8电子结构的是( )
| A、H3O+ | B、BF3 | C、CF2Cl2 | D、PCl5 |
分析:各元素满足|元素化合价|+该元素原子最外层电子数=8,则该原子满足8电子结构,微粒中含有H原子,该微粒一定不满足所有原子都满足最外层为8电子结构,据此结合选项判断.
解答:解:A、H3O+中含有氢原子,不满足8电子结构,故A不符合;
B、BF3中B元素的化合价为+3,B原子最外层电子数为3,则3+3=6,故B原子不满足8电子结构;F元素化合价为-1,Cl原子最外层电子数为7,所以1+7=8,F原子满足8电子结构,故B不符合;
C、CF2Cl2中C元素化合价为+4,C原子最外层电子数为4,所以4+4=8,C原子满足8电子结构;F元素化合价为-1,F原子最外层电子数为7,所以1+7=8,F原子满足8电子结构,Cl元素化合价为-1,Cl原子最外层电子数为7,所以1+7=8,Cl原子满足8电子结构,故C符合;
D、PCl5中中P元素的化合价为+5,P原子最外层电子数为5,则5+5=8,故P原子不满足8电子结构,氯元素化合价为-1价,氯原子最外层电子数为7,则|-1|+7=8,Cl原子满足8电子结构,故D不符合;
故选:C.
B、BF3中B元素的化合价为+3,B原子最外层电子数为3,则3+3=6,故B原子不满足8电子结构;F元素化合价为-1,Cl原子最外层电子数为7,所以1+7=8,F原子满足8电子结构,故B不符合;
C、CF2Cl2中C元素化合价为+4,C原子最外层电子数为4,所以4+4=8,C原子满足8电子结构;F元素化合价为-1,F原子最外层电子数为7,所以1+7=8,F原子满足8电子结构,Cl元素化合价为-1,Cl原子最外层电子数为7,所以1+7=8,Cl原子满足8电子结构,故C符合;
D、PCl5中中P元素的化合价为+5,P原子最外层电子数为5,则5+5=8,故P原子不满足8电子结构,氯元素化合价为-1价,氯原子最外层电子数为7,则|-1|+7=8,Cl原子满足8电子结构,故D不符合;
故选:C.
点评:本题考查8电子结构的判断,难度不大,清楚元素化合价绝对值+元素原子的最外层电子层=8,则该元素原子满足8电子结构是关键,注意离子化合物不适合.

练习册系列答案
相关题目
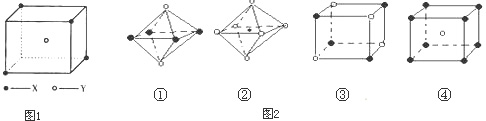
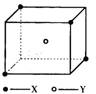
(10分)某离子晶体晶胞结构如图所示,X位于立方体的顶点,Y位于立方体中心。试分析: 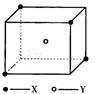
(1)晶体中每个Y同时吸引着____个X,该晶体的化学式为_____ 。
(2)晶体中在每个X周围与它最接近且距离相等的X共有________个。
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX的度数为_______。(4)设该晶体的化学式的式量为M,晶体密度为ρ,阿伏加德罗常数为NA则晶体中两个距离最近的X中心间的距离为__________ 。
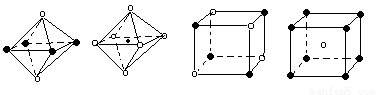
(5)下列图象是从NaCl或CsCl晶体结构图中分割出来的部分结构图,试判断NaCl晶体结构的图象是 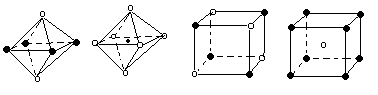
① ② ③ ④
| A.① | B.② | C.③ | D.④ |
| 分子或离子 | H2S | SnCl62- | PH3 | ClO4-- |
| 空间构型 | | | | |