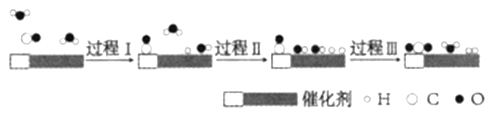
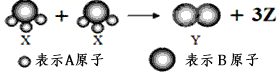
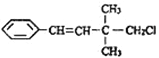
题目内容
【题目】某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1 mol/L。
阳离子 | K+、Mg2+、Fe3+、Al3+、Fe2+ |
阴离子 | Cl-、 |
某同学欲探究废水的组成,进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
②取少量溶液,加入KSCN溶液无明显变化。
③另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
④向③中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由①、②、③判断,溶液中一定不含有的阴离子是______________,一定不含有的阳离子是_____________(写离子符号)。
(2)③中加入少量盐酸生成无色气体的离子方程式是___________________________,④中生成白色沉淀的离子方程式是___________________________。
(3)将③中所得红棕色气体通入水中,气体变无色,所发生反应的化学方程式为__________________________。
(4)该同学最终确定原溶液中所含阴离子是___________,阳离子是________________写离子符号)。
【答案】![]() 、
、![]() K+、Fe3+ 3Fe2++
K+、Fe3+ 3Fe2++![]() +4H+=3Fe3++NO↑+2H2O Ba2++
+4H+=3Fe3++NO↑+2H2O Ba2++![]() =BaSO4↓ 3NO2+H2O=2HNO3+NO Cl-、
=BaSO4↓ 3NO2+H2O=2HNO3+NO Cl-、![]() 、
、![]() Fe2+、Mg2+
Fe2+、Mg2+
【解析】
用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察),说明没有K+;
②取少量溶液,加入KSCN溶液无明显变化,说明没有Fe3+;
③另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变,说明Fe2+与NO3和H+反应生成NO,即溶液中有Fe2+、NO3,加盐酸溶液中阴离子种类不变,说明原溶液中有Cl无![]() ,加盐酸溶液依然澄清说明没有SiO32;
,加盐酸溶液依然澄清说明没有SiO32;
④向③中所得的溶液中加入BaCl2溶液,有白色沉淀生成,说明有SO42;
(1)由①、②、③判断,溶液中一定不含有的阳离子是K+、Fe3+,一定不含有的阳离子是![]() 、SiO32;故答案为:
、SiO32;故答案为:![]() 、SiO32;K+、Fe3+;
、SiO32;K+、Fe3+;
(2) ③中加入少量盐酸生成无色气体,是Fe2+与NO3和H+反应生成NO,其离子方程式:3Fe2++NO3+4H+═3Fe3++NO↑+2H2O;
故答案为:3Fe2++NO3+4H+═3Fe3++NO↑+2H2O;
(3)将③中所得红棕色气体为二氧化氮,通入水中,与水反应生成NO,气体变无色,所发生的化学方程式为3NO2+H2O=2HNO3+NO,向③中所得的溶液中加入BaCl2溶液,有白色沉淀生成,离子方程式是Ba2++![]() =BaSO4↓;
=BaSO4↓;
故答案为:3NO2+H2O=2HNO3+NO;Ba2++![]() =BaSO4↓;
=BaSO4↓;
(4)由以上推断可知溶液中阴离子为Cl、NO3、SO42,且各为0.1mol/L;已经推断出的阳离子是Fe2+,其浓度为0.1mol/L,由电荷守恒可知溶液中还有一种+2价阳离子,所以还有Mg2+,所以甲同学最终确定原溶液中所含阳离子是:Fe2+、Mg2+;阴离子是:Cl、NO3、SO42;
故答案为:、NO3、SO42、Cl; Fe2+、Mg2+

 阅读快车系列答案
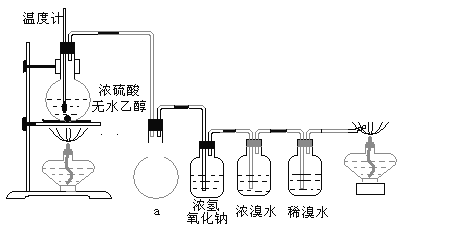
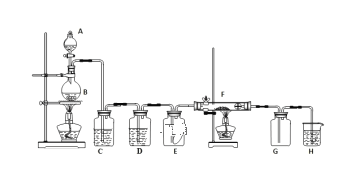
阅读快车系列答案【题目】溴苯是一种化工原料,实验室合成溴苯装置图及有关数据如下:
项目 | 苯 | 溴 | 溴苯 |
密度/(g·cm-3) | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
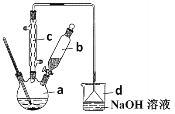
(1)在a中加入15mL无水苯和少量铁屑,在b中小心加入4.0mL液态溴。仪器c的名称是____________,其进水口为_____(填“上”或“下”)口,装置d中倒置漏斗作用为________。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。NaOH溶液洗涤的作用是_______。
③向分出的粗溴苯中加入少量的无水硫酸镁,静置、过滤。
(3)经以上分离操作后,要进一步提纯,下列操作中必需的是____(填入正确选项前的字母):
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)将d中的NaOH溶液换成硝酸银溶液,则出现的现象为_____________,该现象_____(填“能”或“不能”)说明该反应为取代反应。
解决(3)时用到题干中的哪些信息_______