题目内容
已知1g火箭燃料肼(N2H4)气体燃烧生成N2和H2O(g)时,放出16.7kJ的热量,则该反应的热化学方程式正确的是( )
分析:热化学方程式的书写:标明物质的聚集状态;焓变符号中的“+”和“-”代表吸热和放热,化学反应的焓变和物质的量相对应.
解答:解:A、没注明物质的聚集状态,故A错误;
B、1g火箭燃料肼(N2H4)气体燃烧生成N2和H2O(g)时,放出16.7kJ的热量,则32g肼(N2H4)气体燃烧生成N2和H2O(g)时,放出534.4kJ的热量,即N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.4kJ/mol,故B正确;
C、反应为放热,焓变为负值,故C错误;
D、1g火箭燃料肼(N2H4)气体燃烧生成N2和H2O(g)时,放出16.7kJ的热量,化学反应的焓变和反应掉的肼的量不对应,故D错误.
故选B.
B、1g火箭燃料肼(N2H4)气体燃烧生成N2和H2O(g)时,放出16.7kJ的热量,则32g肼(N2H4)气体燃烧生成N2和H2O(g)时,放出534.4kJ的热量,即N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.4kJ/mol,故B正确;
C、反应为放热,焓变为负值,故C错误;
D、1g火箭燃料肼(N2H4)气体燃烧生成N2和H2O(g)时,放出16.7kJ的热量,化学反应的焓变和反应掉的肼的量不对应,故D错误.
故选B.
点评:本题主要考查了热化学方程式的书写,难度不大,根据课本知识即可完成.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
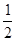 N2H4(g)+
N2H4(g)+