��Ŀ����
����Ŀ�������й�ͼʾ˵����ȷ���ǣ� ��

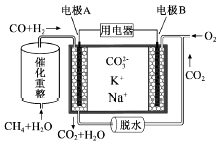
A. ͼ��Ϊ����ȼ�ϵ�ؽ���ˮ�е��Ҷ���[H2N(CH2)2NH2]�����ɻ����Ѻõ����ʣ� (a��b ��Ϊʯī�缫����a �缫������Ӧ��H2N(CH2)2NH2+16e-+4H2O==2CO2��+N2��+16H+
B. ͼ�ұ�ʾ��Ӧ�����С�����������
C. �������� 10mL 0.1mol/L ��ij��(HA) ��Һ����μ��� 0.1mol/L �İ�ˮ��������Һ�� pH��������������백ˮ�������ϵ��ͼ��b �� HA ��Һ�백ˮǡ����ȫ��Ӧ
D. ͼ����ʾ��Ӧ N2(g)��3H2(g)![]() 2NH3(g)ƽ��ʱ NH3�����������ʼ n(N2)/n(H2)�仯�����ߣ���ת���ʣ���A(H2)����B(H2)
2NH3(g)ƽ��ʱ NH3�����������ʼ n(N2)/n(H2)�仯�����ߣ���ת���ʣ���A(H2)����B(H2)
���𰸡�C
��������A��H2N��CH2��NH2�ڸ���M��ʧ���ӷ���������Ӧ�����ɵ�����������̼��ˮ���缫��ӦʽΪH2N��CH2��NH2+4H2O-16e���T2CO2��+N2��+6H������A����B����ͼ��֪����Ӧ���������С������������������÷�ӦΪ���ȷ�Ӧ����Ӧ����ܼ��ܴ�����������ܼ��ܣ���B����C����������10 mL0.1mol��L��1��ij�ᣨHA����Һ����μ���0.1mol��L��1�İ�ˮ��b�㰱ˮΪ10mL����b��HR��һˮ�ϰ������ʵ�����ȣ�����ǡ�÷�Ӧ����NH4R����C��ȷ��D����ͼ���֪��A��B״̬ʱNH3�İٷֺ�����ȣ����������ַ�Ӧ��μӵĿ��淴Ӧ����������һ�ַ�Ӧ������Ͽ�ʹ����һ�ַ�Ӧ���ת�������ӣ�A״̬ʱ��n(N2)/n(H2)ֵ��С������Ϊ��������H2����ʹ��H2������ת���ʱ�С��B״̬ʱ��n(N2)/n(H2)ֵ�ϴ���Ϊ��������N2�������Ӷ������H2��ת���ʣ�ת���ʦ�A��H2����һ�����ڦ�B��H2������D����ѡ��C��

 ѧ���쳵�����ּ��ں�����ҵϵ�д�
ѧ���쳵�����ּ��ں�����ҵϵ�д�����Ŀ�� Fe��Mg��H2SO4��Ӧ��ʵ�����£�
ʵ�� |
|
|
|
|
���� | Fe�������������ɫ���� | Fe����������ݺ�Ѹ��ֹͣ | Mg����Ѹ�ٲ����������� | Fe�����д������ݣ�Mg�������������� |
��������ʵ��˵�������������� ��
A��I�в��������ԭ���ǣ�Fe + 2H��=Fe2��+ H2��
B��ȡ�����е���������CuSO4��Һ������������ɫ����
C����������˵��Mg��ŨH2SO4��û���ۻ�
D����������˵��Mg�Ľ����Ա�Feǿ
����Ŀ�����Ϊ���ֶ�����Ԫ�ص�����,�ش���������:
Ԫ�ر�� | A | B | C | D | E | F | G | H |
ԭ�Ӱ뾶/10-1nm | 0.74 | 1.54 | 1.30 | 1.18 | 1.11 | 1.06 | 0.99 | 0.75 |
�����ͻ��ϼ� | -2 | +1 | +2 | +3 | +4��-4 | +5��-3 | +7��-1 | +5��-3 |
(1)EԪ����Ԫ�����ڱ��е�λ����_____��CԪ����GԪ���γɻ�����ĵ���ʽ_____ ��
(2)D�ĵ�����B������������Ӧˮ�������Һ��Ӧ,�����ӷ���ʽΪ_________��
(3)B2A2�к��еĻ�ѧ��Ϊ_______����������ˮ��Ӧ�Ļ�ѧ��Ӧ����ʽΪ________��
(4)����˵������ȷ����______(�����)��
��H����̬�⻯��ˮ��Һ�ܵ��磬˵��H����̬�⻯��Ϊ�����
������������Ӧˮ����ļ���:B>C>D
��D������������Ӧˮ����������ڰ�ˮ
��Ԫ����̬�⻯����ȶ���:F>A>G