题目内容
10.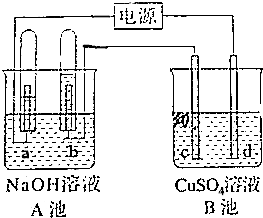 如图所示,A池用石墨电极电解pH=13的Na0H溶液100mL,B池为模拟电解精炼铜的装置,其中c电极为纯铜,d电极为粗铜(含有杂质Fe、Ag),溶液是足量CuSO4溶液,通电一段时间后停止电解,A池a极上产生的气体在标准状况下为2.24L,则下列说法正确的是( )
如图所示,A池用石墨电极电解pH=13的Na0H溶液100mL,B池为模拟电解精炼铜的装置,其中c电极为纯铜,d电极为粗铜(含有杂质Fe、Ag),溶液是足量CuSO4溶液,通电一段时间后停止电解,A池a极上产生的气体在标准状况下为2.24L,则下列说法正确的是( )| A. | d电极质量一定减少6.4g | B. | c电极质量一定增加6.4g | ||
| C. | A池pH不变 | D. | A池溶液质量减少3.6g |
分析 B池为模拟电解精炼铜的装置,其中c电极为纯铜,所以c是阴极,d电极为粗铜(含有杂质Fe、Ag),所以d是阳极,所以a是阴极,b是阳极,电解氢氧化钠实质是电解水,所以a电极上产生氢气,b电极上产生氧气,a极上产生的气体氢气在标准状况下为2.24L,根据电子守恒进行计算即可.
解答 解:池为模拟电解精炼铜的装置,其中c电极为纯铜,所以c是阴极,d电极为粗铜(含有杂质Fe、Ag),所以d是阳极,所以a是阴极,b是阳极,电解氢氧化钠实质是电解水,所以a电极上产生氢气,b电极上产生氧气,a极上产生的气体氢气在标准状况下为2.24L即0.1mol,根据电极反应:2H++2e-=H2↑,转移电子是0.2mol.
A、在d电极上显示活泼金属Fe失电子,然后是金属铜失电子,所以电极质量减少量小于6.4g,故A错误;
B、c电极是阴极,电极反应为:Cu2++2e-═Cu,转移电子是0.2mol,析出金属铜是0.1mol,所以质量一定增加6.4g,故B正确;
C、电解氢氧化钠相当于电解水,电解后pH增大,故C错误;
D、A池中电解的是水,2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,转移电子0.2mol,消耗水的物质的量是1.8g,故D错误.
故选B.
点评 本题综合考查电解池知识,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握电解池的工作原理以及电极方程式的书写,难度中等.

练习册系列答案
相关题目
18.用惰性电极电解饱和食盐水,如果阴极附近产生了8g的气体,则阳极产生的气体在标准状况下的体积是( )
| A. | 22.4L | B. | 44.8L | C. | 89.6L | D. | 1120L |
5.从节约原料,保护环境的角度来分析,要制取一定量的硝酸铜晶体,下列实验设计中最合理的是( )
| A. | Cu与4HNO3(浓)反应 | |
| B. | Cu与8HNO3(稀)反应 | |
| C. | Cu在空气加热后生成CuO,再将CuO与硝酸反应 | |
| D. | Cu在氯气加热后生成CuCl2,再将CuCl2溶于硝酸 |
2.下列浓度关系错误的是( )
| A. | Na2C03溶液中:c(Na+)>c(C032-)>c(OH-)>c(HC03-)>c(H+) | |
| B. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:2c(Na+)=c(CH3COOH)+c(CH3C00-) | |
| C. | NaHC03溶液中:c(C032-)+c(OH-)=c(H+)+c(H2C03) | |
| D. | 氯水中:c(Cl2)=2c(ClO-)+2c(Cl-)+2c(HClO) |
12.下列说法正确的是( )
| A. | 熔化状态下,能导电的物质一定是电解质 | |
| B. | 溶于水能导电的物质一定是电解质 | |
| C. | 熔化状态下,不能导电的化合物一定不是电解质 | |
| D. | BaSO4是强电解质 |
13.有下列四种溶液:①NaOH溶液,②Mg(NO3)2溶液,③CuSO4溶液,④KCl溶液,不用其他试剂就能鉴别,正确的鉴别顺序是( )
| A. | ①②③④ | B. | ③④②① | C. | ④①②③ | D. | ③①②④ |