题目内容
2.下列浓度关系错误的是( )| A. | Na2C03溶液中:c(Na+)>c(C032-)>c(OH-)>c(HC03-)>c(H+) | |
| B. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:2c(Na+)=c(CH3COOH)+c(CH3C00-) | |
| C. | NaHC03溶液中:c(C032-)+c(OH-)=c(H+)+c(H2C03) | |
| D. | 氯水中:c(Cl2)=2c(ClO-)+2c(Cl-)+2c(HClO) |
分析 A.碳酸钠是强碱弱酸盐,碳酸根离子水解导致溶液呈碱性,但水解程度较小;
B.任何电解质溶液中都存在物料守恒,根据物料守恒判断;
C.碳酸氢钠溶液中存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断;
D.氯水中氯气溶解性很小,大部分以氯气分子存在.
解答 解:A.碳酸钠是强碱弱酸盐,碳酸根离子水解导致溶液呈碱性,但水解程度较小,钠离子不水解,水电离生成氢氧根离子,所以离子浓度大小顺序是c(Na+)>c(C032-)>c(OH-)>c(HC03-)>c(H+),故A正确;
B.任何电解质溶液中都存在物料守恒,根据物料守恒得2c(Na+)=c(CH3COOH)+c(CH3C00-),故B正确;
C.碳酸氢钠溶液中存在电荷守恒和物料守恒,根据电荷守恒得c(Na+)+c(H+)=2c(C032-)+c(OH-)+c(HC03-),
根据物料守恒得c(Na+)=c(C032-)+c(H2C03)+c(HC03-),
所以得c(C032-)+c(OH-)=c(H+)+c(H2C03),故C正确;
D.氯水中氯气溶解性很小,大部分以氯气分子存在,所以不存在c(Cl2)=2c(ClO-)+2c(Cl-)+2c(HClO),故D错误;
故选D.
点评 本题考查离子浓度大小比较,为高频考点,涉及盐类水解和弱电解质的电离,明确溶液中溶质及溶液酸碱性是解本题关键,注意守恒思想的应用,易错选项是D.

练习册系列答案
相关题目
10.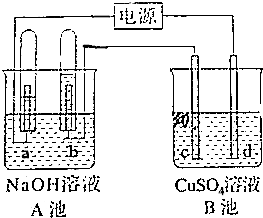 如图所示,A池用石墨电极电解pH=13的Na0H溶液100mL,B池为模拟电解精炼铜的装置,其中c电极为纯铜,d电极为粗铜(含有杂质Fe、Ag),溶液是足量CuSO4溶液,通电一段时间后停止电解,A池a极上产生的气体在标准状况下为2.24L,则下列说法正确的是( )
如图所示,A池用石墨电极电解pH=13的Na0H溶液100mL,B池为模拟电解精炼铜的装置,其中c电极为纯铜,d电极为粗铜(含有杂质Fe、Ag),溶液是足量CuSO4溶液,通电一段时间后停止电解,A池a极上产生的气体在标准状况下为2.24L,则下列说法正确的是( )
 如图所示,A池用石墨电极电解pH=13的Na0H溶液100mL,B池为模拟电解精炼铜的装置,其中c电极为纯铜,d电极为粗铜(含有杂质Fe、Ag),溶液是足量CuSO4溶液,通电一段时间后停止电解,A池a极上产生的气体在标准状况下为2.24L,则下列说法正确的是( )
如图所示,A池用石墨电极电解pH=13的Na0H溶液100mL,B池为模拟电解精炼铜的装置,其中c电极为纯铜,d电极为粗铜(含有杂质Fe、Ag),溶液是足量CuSO4溶液,通电一段时间后停止电解,A池a极上产生的气体在标准状况下为2.24L,则下列说法正确的是( )| A. | d电极质量一定减少6.4g | B. | c电极质量一定增加6.4g | ||
| C. | A池pH不变 | D. | A池溶液质量减少3.6g |
17.某酸溶液中c(H+)=0.1mol/L,则该酸溶液的物质的量浓度( )
| A. | 一定等于0.1mol/L | B. | 一定大于0.1mol/L | ||
| C. | 一定小于0.1mol/L | D. | 无法确定 |
7.一定温度下,在容积为2L的密闭容器中发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),部分数据如表所示(表中t2>t1),下列说法正确的是( )
| 反应时间/min | n(CO)/mol | n(H2O)/mol | n(CO2)/mol | n(H2)/mol |
| 0 | 1.2 | 0.60 | 0 | 0 |
| t1 | 0.80 | |||
| t2 | 0.20 |
| A. | 0~t1 min内的平均反应速率v(H2)=$\frac{0.2}{{t}_{1}}$mol•L-1•min-1 | |
| B. | 平衡时CO的转化率为66.67% | |
| C. | t1时刻该反应处于平衡状态 | |
| D. | t2时刻CO的浓度为0.8 mol•L-1 |
5.下列有关判断化学基本概念的依据中,一定正确的是( )
| A. | 离子晶体:由阴阳离子构成的晶体 | B. | 共价化合物:含有共价键的化合物 | ||
| C. | 酸性:PH<7 | D. | 强电解质:能溶于水的化合物 |