题目内容
【题目】下列关于合金的说法中错误的是
A. 铝合金中除Al外,还含有Cu、Mg、Si、Zn等
B. 生铁和钢都是铁碳合金
C. 我国在商代就已制造和使用的青铜器其成分主要是Cu-Zn合金
D. 金首饰中常加入一定量的Cu或Ag以增大硬度
【答案】C
【解析】
根据常见合金的成分及合金的特性进行判断。
A. 铝合金中除Al外,还含有Cu、Mg、Si、Zn等,选项A正确;B. 生铁和钢都是铁碳合金,选项B正确;C. 我国在商代就已制造和使用的青铜器其成分主要是Cu-Sn合金,Cu-Zn合金是黄铜的成分,选项C错误;D. 纯金较软,为了增加其硬度,金首饰中常加入一定量的Cu或Ag以增大硬度,选项D正确。答案选C。

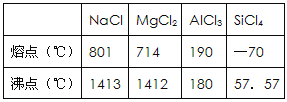
【题目】下表是元素周期表的一部分,除标出的元素外,表中的每个编号都代表一种元素,请根据要求回答问题:
族 周期 | IA | 0 | |||||||
1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |||
2 | ① | ② | Ne | ||||||
3 | ③ | ④ | ⑤ | ⑥ | |||||
(1)元素①的最低价氢化物和最高价氧化物的水化物反应得到一种离子化合物的化学式为________________;
(2)②和⑥两种元素的原子半径大小关系:②________⑥(填“>”或“<”);
(3)③和⑤两种元素的金属性强弱关系:③________⑤(填“>”或“<”),它们的最高价氧化物对应水化物反应的离子方程式为__________________________________________;
(4)④的单质与⑥的最高价氧化物对应的水化物的稀溶液反应的离子方程式:________________________________。
【题目】某化学兴趣小组,通过下图装置进行硫酸与铜反应的实验探究。
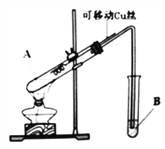
⑴提出假设:
假设一:加热时,稀H2SO4与Cu能反应。
假设二:加热时,浓H2SO4与Cu能反应。
⑵设计实验:
实验编号 | 实验操作 | 实验现象 |
1 | 将Cu丝与稀H2SO4接触,加热 | 试管B中溶液无明显变化 |
2 | 将Cu丝与浓H2SO4接触,加热 | 试管B中溶液褪色 |
实验前,试管B盛放的是_______________溶液(填“品红”或“酚酞”)。
⑶实验结论:通过以上实验,说明浓硫酸具有____________________(填写字母代号)。
A.强氧化性 B.脱水性 C.吸水性
⑷问题与计论:
①有同学认为该装置不完善,Cu与浓H2SO4反应生成了一种大气污染物,该气体是________;他建议在试管B口塞一团棉花,该棉花最好浸泡下列哪种溶液__________(填字母编号);
A.稀盐酸 B.NaOH溶液 C.NaCl溶液
②该兴趣小组在探究Cu与浓H2SO4反应时,将质量5.0g可移动Cu丝部分伸入浓H2SO4中,充分反应后,Cu丝剩余3.4g,将试管A中液体稀释成100ml溶液。该溶液中Cu2+物质的量浓度为_____mol·L-1 。