题目内容
【题目】甲苯氧化法制备苯甲酸的反应原理如下:
![]() + 2KMnO4
+ 2KMnO4![]()
![]() +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O
![]() + HCl
+ HCl![]()
![]() +KCl
+KCl
实验时将一定量的甲苯和KMnO4溶液置于图1装置中,在100 ℃时, 反应一段时间,再停止反应,并按如下流程分离出苯甲酸和回收未反应的甲苯。

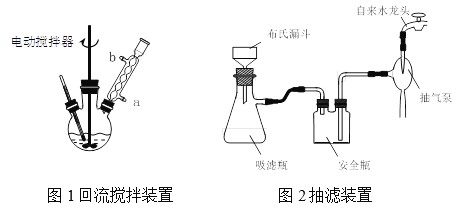
⑴实验室中实现操作Ⅰ所需的玻璃仪器有_____、烧杯;操作Ⅱ的名称为_____。
⑵如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,若无此操作会出现的危害是_______________。
⑶在操作Ⅲ中,抽滤前需快速冷却溶液,其原因是__________;如图2所示抽滤完毕,应先断开_____之间的橡皮管。
⑷纯度测定:称取1.220 g产品,配成100 mL溶液,取其中25.00 mL溶液,进行滴定 ,消耗KOH物质的量为2.4×10-3mol。产品中苯甲酸质量分数为_____。
【答案】 分液漏斗 蒸馏 过量的高锰酸钾氧化盐酸,产生氯气 得到较大的苯甲酸晶粒,便于抽滤 抽气泵和安全瓶 96%
【解析】试题分析:⑴操作I为分液操作,其所需的玻璃仪器有分液漏斗、烧杯;操作II为蒸馏操作得无色液体A。
⑵为了避免过量的高锰酸钾氧化盐酸,产生有毒的氯气,应该先加亚硫酸氢钾除去过量的高锰酸钾,然后再加入浓盐酸酸化。
⑶为了得到较大的苯甲酸晶粒,便于抽滤,应该在抽滤前需快速冷却溶液;为了避免管道里的水在负压下回流,故在抽滤完毕,应先断开抽气泵和安全瓶。
⑷根据“1![]() ~1KOH”,则产品中苯甲酸质量分数为
~1KOH”,则产品中苯甲酸质量分数为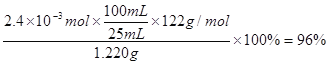 。
。

【题目】下列化学实验操作、现象及结论均正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 取1 mL 20%的蔗糖溶液,加入3~5滴稀硫酸,水浴加热一段时间后,再滴加银氨溶液 | 没有出现银镜 | 蔗糖没有水解 |
B | 锅炉中的水垢用饱和碳酸钠溶液浸泡后,再加入稀盐酸 | 水垢明显减少 | 锅炉沉积物中的CaSO4转化为CaCO3 |
C | 常温下,在0.1 mol·L1氨水中,加入少量NH4Cl晶体 | 溶液的pH减小 | NH4Cl溶液显酸性 |
D | 向饱和Na2CO3溶液中通入足量CO2 | 溶液变浑浊 | NaHCO3为难溶物 |