题目内容
【题目】应用化学反应原理知识解决下列问题
(1)写出醋酸(CH3COOH) 的电离方程式: _____________。
(2)明矾净水的原理为(用离子方程式表示)____________________________。
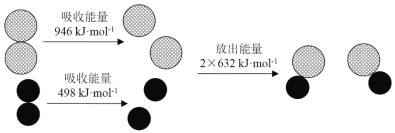
(3)一定条件下,56g金属铁与足量CO2气体完全反应生成碳单质和氧化铁固体时,放出117kJ热量,该反应的热化学方程式为_______________________。
(4) 现有浓度为0.1mol/L 的三种电解质溶液①NaHCO3 ②Na2CO3 ③NaOH 这三种溶液的pH 由小到大的顺序是__________________ (填编号)。
(5)常温下,下列事实能证明HA是弱电解质的是________ (填编号)。
a.某NaA溶液的pH=9
b.用HA 溶液做导电实验,灯泡很暗
c.等物质的量浓度、等体积的硫酸和HA溶液分别与足量锌反应,硫酸产生的氢气多d.0.1mol/LHA 溶液的pH≈2.8
(6)已知在100℃时,水的离子积为1×10-12,此时将 pH= 11 的 NaOH 溶液V1 L 与pH=2的H2SO4溶液V2 L均匀混合后,若所得混合溶液的pH=10,则V1: V2为______。
【答案】 CH3COOH![]() H++CH3COO﹣ Al3++3H2O
H++CH3COO﹣ Al3++3H2O![]() Al(OH)3(胶体)+3H+ 4Fe(s)+3CO2(g) = 2Fe2O3(s)+3C(s) ΔH=-468 kJ·mol-1 ①②③ ad 2∶9
Al(OH)3(胶体)+3H+ 4Fe(s)+3CO2(g) = 2Fe2O3(s)+3C(s) ΔH=-468 kJ·mol-1 ①②③ ad 2∶9
【解析】(1)醋酸是弱酸,电离是可逆过程,电离方程式为CH3COOHCH3COO-+H+,故答案为:CH3COOHCH3COO-+H+;
(2)明矾水解生成氢氧化铝胶体,具有吸附性,反应的离子方程式为Al3++3H2OAl(OH)3(胶体)+3H+,故答案为:Al3++3H2OAl(OH)3(胶体)+3H+;
(3) 56g金属铁的物质的量为1mol,与足量CO2气体完全反应生成碳单质和氧化铁固体时,放出117kJ热量,反应的热化学方程式为4Fe(s)+3CO2(g) = 2Fe2O3(s)+3C(s) ΔH=-117 kJ/mol ×4=-468 kJ/mol,故答案为:4Fe(s)+3CO2(g) = 2Fe2O3(s)+3C(s) ΔH=-468 kJ/mol;
(4)碳酸氢钠是酸式盐,碳酸钠是正盐,所以碳酸钠的pH值大于碳酸氢钠的pH,氢氧化钠是强碱,完全电离,碱性最强,pH最大,三种溶液的pH由小到大的顺序为①②③,故答案为:①②③;
(5)a.某溶液的pH=9,说明溶液中存在NaA的水解过程,能够说明HA是弱电解质,正确;b.用HA溶液做导电实验,灯泡很暗,可能是HA的浓度很小的结果,不能说明HA是弱电解质,错误;c.等物质的量浓度、等体积的硫酸和HA溶液分别与足量锌反应,硫酸产生的氢气多是因为硫酸是二元酸,HA为一元酸,与酸的强弱无关,错误;d.0.1mol/LHA溶液的pH≈2.8,说明HA未完全电离,能够说明HA是弱电解质,正确;故选ad;
(6)在100℃时,水的离子积为1×10-12,此温度下将pH=11的NaOH溶液中c(OH-)=0.1mol/L,pH=2的H2SO4溶液c(H+)=0.01mol/L,若所得混合溶液的pH=10,则反应后的溶液的c(OH-)=![]() mol/L=0.01mol/L,则c(OH-)=
mol/L=0.01mol/L,则c(OH-)=![]() =0.01mol/L,解得:V1:V2=2:9,故答案为:2:9。
=0.01mol/L,解得:V1:V2=2:9,故答案为:2:9。

【题目】下列物质性质与用途的对应关系不正确的是
选项 | 性质 | 用途 |
A | 次氯酸有强氧化性 | 用作漂白剂 |
B | 氧化铝熔点很高 | 制造耐火坩埚 |
C | 硅有导电性 | 制造光导纤维 |
D | 硫酸有酸性 | 用于金属加工前的酸洗 |
A. A B. B C. C D. D