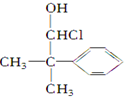
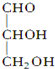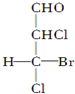题目内容
6.根据下表给出的几种物质的熔点、沸点数据判断说法中错误的是( )| 晶体 | NaCl | MgCl2 | AlCl3 | SiCl4 | 单质R |
| 熔点 | 810℃ | 710℃ | 180℃ | -70℃ | 2300℃ |
| 沸点 | 1465℃ | 1418℃ | 177.8℃ | 57℃ | 2500℃ |
| A. | SiCl4是分子晶体 | |
| B. | MgCl2中键的强度比NaCl中键的强度小 | |
| C. | 单质R可能是原子晶体 | |
| D. | AlCl3为离子晶体 |
分析 晶体熔沸点高低顺序是:原子晶体>离子晶体>分子晶体,根据表中数据知,NaCl、MgCl2都属于离子晶体,AlCl3、SiCl4都属于分子晶体,R熔沸点较高,所以R可能属于原子晶体,据此分析解答.
解答 解:晶体熔沸点高低顺序是:原子晶体>离子晶体>分子晶体,根据表中数据知,NaCl、MgCl2都属于离子晶体,AlCl3、SiCl4都属于分子晶体,R熔沸点较高,所以R可能属于原子晶体,
A.SiCl4熔沸点较低,属于分子晶体,故A正确;
B.离子晶体中键的强度越大其熔沸点越高,NaCl的熔沸点高于MgCl2,所以MgCl2中键的强度比NaCl中键的强度小,故B正确;
C.R熔沸点较高,所以R可能属于原子晶体,故C正确;
D.氯化铝熔沸点较低,所以氯化铝为分子晶体,故D错误;
故选D.
点评 本题考查晶体与熔沸点关系,侧重考查学生分析判断能力,明确晶体熔沸点高低顺序是解本题关键,注意不能根据晶体中是否含有金属元素判断离子晶体,易错选项是D.

练习册系列答案
相关题目
11.根据科学人员探测:在海洋深处的沉积物中含有可燃冰,主要成分是甲烷水合物.其组成的两种分子的下列说法正确的是( )
| A. | 它们都是极性键形成的极性分子 | |
| B. | 它们的成键方式都只有σ键 | |
| C. | 可燃冰的存在说明甲烷和水分子间能形成氢键 | |
| D. | 它们的分子空间构型都相同 |