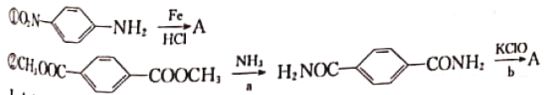题目内容
【题目】半导体有单质、二元化合物、三元化合物等之分,其中三元半导体CuAlO2(或Cu2Al2O4)的制取,常采用CuO与Al2O3或Al(OH)3共热的方法。试分析并回答:
(l)试完成如下化学方程式:
_______CuO+_______ Al2O3![]() _______Cu2Al2O4+_______ ↑
_______Cu2Al2O4+_______ ↑
(2)上述反应能发生的理由主要是_____________。
(3)Al(OH)3有碱式和酸式两种电离方式,若25℃时,其酸式电离为Al(OH)3![]() AlO2-+H++H2O K=2.0×10-13,则入Al(OH)3+OH-
AlO2-+H++H2O K=2.0×10-13,则入Al(OH)3+OH-![]() AlO2-+2H2O的平衡常数K’=_______(列式并计算)。该反应的△H_______(填“<”“>”或“=”)0。
AlO2-+2H2O的平衡常数K’=_______(列式并计算)。该反应的△H_______(填“<”“>”或“=”)0。
(4)经实验测定,“AlO2-” 的形式应该是[Al(OH)4]-,则AlCl3溶液与Na[Al(OH)4]溶液作用的离子方程式是_________________。
(5)用石墨电极电解Na[Al(OH)4] 溶液是制取高品质用Al(OH)3的方法之一。该电解反应的离子方程式是_________________。
【答案】4 2 2 1O2 CuO受热分解生成Cu2O和O2, Cu2O与Al2O3作用生成Cu2Al2O4(Cu+处于全充满稳定结构,固态时更稳定) K’=![]() < 3[Al(OH)4]-+Al3+=4Al(OH)3↓ 4[Al(OH)4]-+2H2O
< 3[Al(OH)4]-+Al3+=4Al(OH)3↓ 4[Al(OH)4]-+2H2O![]() 4Al(OH)3↓+4OH-+2H2↑+O2↑
4Al(OH)3↓+4OH-+2H2↑+O2↑
【解析】
(1)根据氧化还原反应的规律及元素守恒法配平化学方程式;
(2)反应会向生成稳定产物的方向发生;
(3)根据化学平衡常数的定义式变形推导得出结论;根据水解反应是吸热反应分析该反应的热效应;
(4)根据偏铝酸根离子与铝离子的双水解反应作答;
(5)根据电解原理的放电顺序结合电解质的酸碱性分析书写离子方程式。
(1)根据化学式CuAlO2可知Cu显+1价,Al显+3价,则反应CuO+_______ Al2O3![]() _______Cu2Al2O4+_______中,Cu元素化合价降低,根据氧化还原反应的规律可知,氧元素化合价应从-2价升高到0价,推出生成的气体为O2,电子转移数为4,故Cu2Al2O4的化学计量数为2,结合元素守恒可知该反应的化学方程式为:4CuO+2Al2O3
_______Cu2Al2O4+_______中,Cu元素化合价降低,根据氧化还原反应的规律可知,氧元素化合价应从-2价升高到0价,推出生成的气体为O2,电子转移数为4,故Cu2Al2O4的化学计量数为2,结合元素守恒可知该反应的化学方程式为:4CuO+2Al2O3![]() 2Cu2Al2O4+O2↑,故答案为:4;2;2;1O2;
2Cu2Al2O4+O2↑,故答案为:4;2;2;1O2;
(2)CuO受热分解生成Cu2O和O2, Cu2O与Al2O3作用生成Cu2Al2O4,分析分子内部结构可以看出Cu2Al2O4中的Cu+处于全充满稳定结构,固态时更稳定,因此该反应能发生,故答案为:CuO受热分解生成Cu2O和O2, Cu2O与Al2O3作用生成Cu2Al2O4(Cu+处于全充满稳定结构,固态时更稳定);
(3)K’=![]() ,该反应是AlO2-水解反应的逆反应,故该反应为放热反应,该反应的△H<0,故答案为:20;<;
,该反应是AlO2-水解反应的逆反应,故该反应为放热反应,该反应的△H<0,故答案为:20;<;
(4)[Al(OH)4]-= AlO2-+2H2O,故AlCl3溶液与Na[Al(OH)4]溶液会发生双水解反应生成氢氧化铝沉淀,该反应的离子方程式为:3[Al(OH)4]-+Al3+=4Al(OH)3↓;
(5)石墨电极电解Na[Al(OH)4] 溶液,根据溶液中的离子放电顺序可知,阳极水中氢氧根离子放电生成O2和H+,阴极水中的氢离子放电生成H2和OH-,则Al3+在阴极会结合OH-生成Al(OH)3沉淀,反应的总的离子方程式为:4[Al(OH)4]-+2H2O![]() 4Al(OH)3↓+4OH-+2H2↑+O2↑。
4Al(OH)3↓+4OH-+2H2↑+O2↑。

 全优点练单元计划系列答案
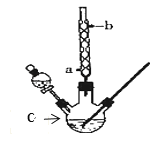
全优点练单元计划系列答案【题目】某化学课外小组设计了如图所示的装置制取乙酸乙酯(图中夹持仪器和加热装置已略去)。已知下列数据:
乙醇 | 乙酸 | 乙酸乙酯 | 98%浓硫酸 | |
熔点/℃ | ﹣117.3 | 16.6 | ﹣83.6 | |
沸点/℃ | 78.5 | 117.9 | 77.5 | 338.0 |
请回答下列问题:
(1)仪器C的名称为______,球形冷凝管的作用是_____。
(2)向C中加入反应物,待充分反应后,将C中的混合物倒入装有饱和碳酸钠溶液的烧杯中充分振荡洗涤。饱和碳酸钠溶液作用是(填字母):_____
A.中和乙酸并溶解乙醇
B.碳酸钠溶液呈碱性,有利于乙酸乙酯的水解
C.加速乙酸乙酯的生成,提高其产率
D.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
(3)经多次振荡洗涤、静置分液后,为了进一步提纯乙酸乙酯,可采用蒸馏的方法,蒸馏时控制温度在__左右,温度计的水银球应位于____。
(4)若实验所用乙酸质量为2.4g,乙醇质量为2.1g,得到纯净的产品质量为2.64g,则乙酸乙酯的产率是______。
(5)乙酸乙酯与氢氧化钠溶液发生反应的化学方程式为____________。