题目内容
【题目】一个容积固定的5 L反应器中,有一可左右滑动的密封隔板,左侧进行如下可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),通过控制温度使其达到不同的平衡状态;右侧充入氮气,两侧温度保持相等。左侧中加入SO2、O2、SO3的物质的量分别为x mol、3.25 mol、1 mol;右侧中加入9 mol的氮气。左侧反应达到平衡时,隔板恰好处于反应器位置2处。则下列说法错误的是
2SO3(g),通过控制温度使其达到不同的平衡状态;右侧充入氮气,两侧温度保持相等。左侧中加入SO2、O2、SO3的物质的量分别为x mol、3.25 mol、1 mol;右侧中加入9 mol的氮气。左侧反应达到平衡时,隔板恰好处于反应器位置2处。则下列说法错误的是
![]()
A.若左侧开始反应时v正>v逆,则5>x>1.75
B.若左侧开始反应时x=1.75,则起始时v正=v逆
C.若左侧开始反应时x=2,则达到平衡时混合气体中SO2所占的体积分数为25%
D.若左侧开始反应时x=1.65,则达到平衡时SO3的转化率为10%
【答案】D
【解析】
由左侧反应达到平衡时,隔板恰好处于反应器位置2处可知,左右容器体积之比为2:3,由阿伏加德罗定律可得平衡时左容器中气体的物质的量为![]() =6mol。
=6mol。
A.该反应为气体体积减小的反应,由左侧开始反应时v正>v逆可知,起始时气体的物质的量大于6mol,即(x+3.25+1)>6,解得x>1.75;若3.25 mol氧气完全反应,可得反应后混合气体的物质的量为(x-6.5+1-6.5)mol,由(x-6.5+1-6.5)=6解得,x=5,因可逆反应不可能完全反应,则x<5,故有5>x>1.75,故A正确;
B.若左侧开始反应时x=1.75,混合气体的物质的量为(1.75+3.25+1)=6,说明反应达到平衡,则起始时v正=v逆,故B正确;
C.若左侧开始反应时x=2,(2+3.25+1)mol=6.25mol>6mol,说明平衡向正反应方向进行,设反应消耗amol二氧化硫,由题意建立如下三段式:

由平衡时气体的物质的量为6,可得(2-2a)+(3.25-a)+(1+2a)=6,解得a=0.25,平衡时二氧化硫的物质的量为1.5mol,平衡时混合气中SO2所占的体积分数为![]() ×100%=25%,故C正确;
×100%=25%,故C正确;
D.若左侧开始反应时x=1.55,(1.55+3.25+1)mol=5.8mol<6mol,说明平衡向逆反应方向进行,设反应消耗amol二氧化硫,由题意建立如下三段式:

由平衡时气体的物质的量为6,可得(1-2a)+(3.25+a)+(1.55+2a)=6,解得a=0.2,即转化率为20%,故D错误;
故选D。

 小题狂做系列答案
小题狂做系列答案【题目】下列装置中同时通入a、b两种气体,瓶中实验现象错误的是
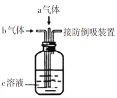
选项 | a气体 | b气体 | c溶液 | 实验现象 |
A | Cl2(1mol) | SO2(1mol) | 品红溶液 | 溶液颜色变浅或褪色 |
B | H2S | SO2 | 水 | 产生淡黄色沉淀 |
C | SO2 | NO2 | BaCl2溶液 | 产生白色沉淀 |
D | NO | O2 | 滴加少量酚酞的NaOH溶液 | 溶液颜色变浅或褪色 |
A.AB.BC.CD.D
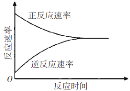
【题目】下列有关图像的结论正确的是
图像 | 结论 | |
A |
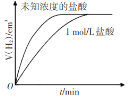
| 相同质量锌粉分别与1 mol/L盐酸及相同体积未知浓度的盐酸反应,未知浓度盐酸的浓度低于1 mol/L |
B |
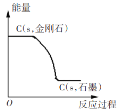
| 一定条件下,金刚石转化为石墨要释放能量,金刚石要比石墨稳定 |
C |
| 该装置为化学能转化为电能的装置,且Mg作负极 |
D |
| 一定条件下,某可逆反应的正反应速率和逆反应速率随时间变化曲线如图,反应开始时刻生成物的浓度不为0 |
A.AB.BC.CD.D
【题目】在酸性溶液中,碘酸钾(KIO3)和Na2SO3可发生如下反应:2![]() +5
+5![]() +2H+=I2+5
+2H+=I2+5![]() +H2O,生成的碘可以用淀粉溶液检验,根据溶液出现蓝色所需的时间来衡量该反应的速率。某学生设计实验如下表所示(表格中体积单位均为mL):
+H2O,生成的碘可以用淀粉溶液检验,根据溶液出现蓝色所需的时间来衡量该反应的速率。某学生设计实验如下表所示(表格中体积单位均为mL):
0.01mol/LKIO3溶液的体积 | 某浓度的Na2SO3溶液的体积 | H2O的体积 | 实验温度/℃ | 溶液出现蓝色所需时间 | |
实验1 | 5 | 5 | V1 | 0 | a |
实验2 | 5 | 5 | 20 | 25 | b |
实验3 | 5 | V2 | 15 | 25 | c |
(1)V1=______ mL,V2=______ mL。
(2)如果研究浓度对反应速率的影响,使用实验__________和实验__________。
(3)对比实验1和实验2,可以研究__________对化学反应速率的影响。
(4)溶液出现蓝色所需的时间从多到少的顺序是__________(用a、b、c表示)。
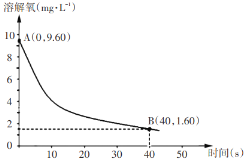
(5)已知反应:2Na2SO3(aq)+O2(aq)=2Na2SO4(aq)。在291.5K时,1.0 L溶液中Na2SO3初始量为10 mmol(1 mol=103 mmol),每5s记录一次溶解氧浓度,一段时间后实验结果如曲线,求0-40s内Na2SO