题目内容
【题目】以下为工业从海水中提取液溴的流程图:
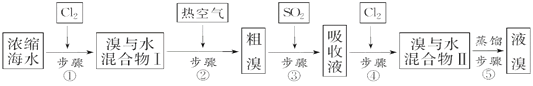
已知:溴的沸点为59 ℃,微溶于水,有毒性。请回答:
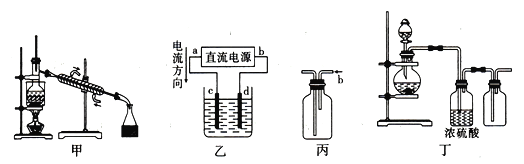
(1)某同学利用下图1装置进行步骤①至步骤④的实验,当进行步骤①时,应关闭活塞_______,打开活塞____________。
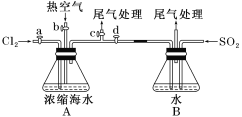
(2)步骤②中可根据____________________________现象,简单判断热空气的流速。
(3)步骤③中简单判断反应完全的依据是___________________________。
(4)从“溴水混合物Ⅰ”到“溴水混合物Ⅱ”的目的是___________________________。
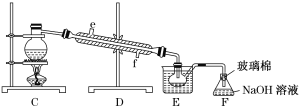
(5)步骤⑤用下图装置进行蒸馏,蒸馏烧瓶中尚未安装温度计,安装其位置时应注意_____,装置C中直接加热不合理,应改为______,图中E、F的作用是____________________、______________________。
【答案】bdacA中气泡产生的快慢B中溶液褪色浓缩Br2或富集溴温度计的水银球在蒸馏烧瓶的支管口附近水浴加热收集溴吸收尾气
【解析】
浓缩海水中加入氯气氧化溴离子得到溴水的混合物,利用热的空气吹出溴单质,得到粗溴,通入二氧化硫吸收溴单质发生氧化还原反应生成溴化氢,再通入氯气氧化溴离子得到溴与水的溶液蒸馏得到液溴,据此解答。
(1)进行步骤①的目的是通入氯气氧化溴离子,且能使氯气通入和浓缩海水中的溴离子反应,剩余氯气进行尾气吸收,应关闭bd,打开ac,进行反应和尾气处理;
(2)步骤②是利用溴单质易挥发的性质,关闭ac,打开bd,通入热空气把生成的溴单质赶出到装置B,和通入的二氧化硫发生氧化还原反应生成硫酸和溴化氢,依据气泡冒出的快慢判断热空气的流速,即通过A装置中直玻璃管产生气泡的快慢现象,简单判断热空气的流速;
(3)步骤③中是二氧化硫和溴单质发生氧化还原反应生成溴化氢和硫酸,因此简单判断反应完全的依据是溴水溶液的橙色变为无色,溴水褪色,即B中橙色刚好褪去;
(4)海水中溴元素较少,从“溴水混合物Ⅰ”到“溴水混合物Ⅱ”过程中,目的是增大溴单质的浓度,富集溴元素;
(5)蒸馏装置中温度计是测定馏出成分的温度,蒸馏烧瓶中安装温度计,安装时应注意温度计水银球在蒸馏烧瓶的支管口处,烧瓶加热面积较大,为均匀加热应隔着石棉网加热进行,为提供稳定的温度,避免温度过高,装置C应改为水浴加热,装置E是冷凝溴蒸气得到液溴。溴有毒,装置F中的氢氧化钠溶液用来吸收溴蒸气,防止污染空气。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案