题目内容
【题目】已知2A2(g)+B2(g) ![]() 2C3(g) △H=-Q1kJ·mol-1(Q>0)。在一个有催化剂的容积不变的密闭容器中加入2molA2和1molB2,在500℃时充分反应,达平衡后C3的浓度为w mol/L。放出热量为Q2KJ
2C3(g) △H=-Q1kJ·mol-1(Q>0)。在一个有催化剂的容积不变的密闭容器中加入2molA2和1molB2,在500℃时充分反应,达平衡后C3的浓度为w mol/L。放出热量为Q2KJ
(1)达到平衡时,A2的转化率为_______。
(2)达到平衡后,若向容器中通入少量的氩气,A2的转化率将______(填增大、减小或不变))
(3)若在原来的容器中只加入2mol C3,500℃时充分反应达平衡后,吸收热量QkJ,C3浓度________(填>、=、<)wmol/L。
(4)改变某一条件,得到如图的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是_____;

a.反应速率c>b>a
b.达到平衡时A2的转化率大小为b>a>c
c.T2>T1
d.b点A2和B2的物质的量之比为2:1
(5)若将上述容器改为恒压容器,起始时加入2mol A2和1mol B2,500℃时充分反应达平衡后,放出热量Q1kJ,则Q2_________Q1(填>、=、<)。
(6)下列措施可以同时提高反应速率和B2的转化率是______(填选项序号)。
a.选择适当的催化剂 b.增大压强 c.及时分离生成的C3 d.升高温度
【答案】 Q2/Q1 不变 = ad < b
【解析】试题分析:(1)根据2A2(g)+B2(g) ![]() 2C3(g) △H=-Q1kJ·mol-1,放出Q2KJ 的能量消耗A2 的物质的量为
2C3(g) △H=-Q1kJ·mol-1,放出Q2KJ 的能量消耗A2 的物质的量为![]() ,根据
,根据![]() 计算A2的转化率;(2)达到平衡后,若向容器中通入少量无关气体,浓度不变,Q不变,平衡不移动;(3)正向投入2molA2和1molB2,与逆向投入2molC3,是等效平衡;(4)B2的物质的量浓度越大,反应速率越快;增大B2的物质的量,平衡正向移动,A2的转化率增大;在B2相同时,比较C3平衡时的体积分数,可以分析温度的大小关系;投料比等于系数比时,达到平衡时产物含量最大。
计算A2的转化率;(2)达到平衡后,若向容器中通入少量无关气体,浓度不变,Q不变,平衡不移动;(3)正向投入2molA2和1molB2,与逆向投入2molC3,是等效平衡;(4)B2的物质的量浓度越大,反应速率越快;增大B2的物质的量,平衡正向移动,A2的转化率增大;在B2相同时,比较C3平衡时的体积分数,可以分析温度的大小关系;投料比等于系数比时,达到平衡时产物含量最大。
(5)2A2(g)+B2(g) ![]() 2C3(g)正反应物质的量减小,恒压条件下,由于始终保持较大压强,转化的越多,放出热量较多。(6)根据影响反应速率的因素分析改变条件对速率、根据影响化学平衡移动的因素分析改变条件对B2的转化率的影响。
2C3(g)正反应物质的量减小,恒压条件下,由于始终保持较大压强,转化的越多,放出热量较多。(6)根据影响反应速率的因素分析改变条件对速率、根据影响化学平衡移动的因素分析改变条件对B2的转化率的影响。
解析:(1)根据2A2(g)+B2(g) ![]() 2C3(g) △H=-Q1kJ·mol-1,放出Q2KJ 的能量消耗A2 的物质的量为
2C3(g) △H=-Q1kJ·mol-1,放出Q2KJ 的能量消耗A2 的物质的量为![]() , A2的转化率
, A2的转化率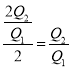 ;(2)达到平衡后,若向容器中通入少量无关气体,浓度不变,Q不变,平衡不移动,A2的转化率不变;(3)正向投入2molA2和1molB2,与逆向投入2molC3,是等效平衡,达到平衡C3浓度=wmol/L;(4)B2的物质的量浓度越大,反应速率越快,反应速率c>b>a,故a正确;增大B2的物质的量,平衡正向移动,A2的转化率增大, 所以达到平衡时A2的转化率大小为c>b>a,故b错误; 在B2相同时,
;(2)达到平衡后,若向容器中通入少量无关气体,浓度不变,Q不变,平衡不移动,A2的转化率不变;(3)正向投入2molA2和1molB2,与逆向投入2molC3,是等效平衡,达到平衡C3浓度=wmol/L;(4)B2的物质的量浓度越大,反应速率越快,反应速率c>b>a,故a正确;增大B2的物质的量,平衡正向移动,A2的转化率增大, 所以达到平衡时A2的转化率大小为c>b>a,故b错误; 在B2相同时, ![]() 时C3的平衡体积分数大于T1,正反应放热,升高温度反应逆向移动,温度越高C3含量约小,所以T2<T1,故c错误;投料比等于系数比时,达到平衡时产物浓度最大,故d正确。(5)2A2(g)+B2(g)
时C3的平衡体积分数大于T1,正反应放热,升高温度反应逆向移动,温度越高C3含量约小,所以T2<T1,故c错误;投料比等于系数比时,达到平衡时产物浓度最大,故d正确。(5)2A2(g)+B2(g) ![]() 2C3(g)正反应物质的量减小,恒压条件下,由于始终保持较大压强,转化的越多,放出热量较多,所以Q2<Q1。(6)加入适当的催化剂,平衡不移动,故a错误; b.增大压强,反应速率加快,平衡正向移动,故b正确;c.及时分离生成的C3 ,反应速率减慢,故c错误; d.升高温度,平衡逆向移动,故d错误。
2C3(g)正反应物质的量减小,恒压条件下,由于始终保持较大压强,转化的越多,放出热量较多,所以Q2<Q1。(6)加入适当的催化剂,平衡不移动,故a错误; b.增大压强,反应速率加快,平衡正向移动,故b正确;c.及时分离生成的C3 ,反应速率减慢,故c错误; d.升高温度,平衡逆向移动,故d错误。

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案【题目】下表是25℃时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是
化学式 | CH3COOH | H2CO3 | AgCl | Ag2CrO4 |
Ka或Ksp | Ka=1.8×10﹣5 | Ka1=4.1×10﹣7 Ka2=5.6×10﹣11 | Ksp=1.8×10﹣10 | Ksp=2.0×10﹣12 |
A. 常温下,相同浓度①CH3COONH4 ②NH4HCO3 ③(NH4)2CO3溶液中,c(NH4+)由大到小的顺序是:①>②>③
B. 向饱和氯水中滴加NaOH 溶液至溶液刚好为中性时,c(Na+)=2c(ClO﹣)+c(HClO)
C. AgCl 易溶于氨水难溶于水,所以AgCl 在氨水中的Ksp 大于水中的 Ksp
D. 向浓度均为1×10﹣3molL﹣1的KCl 和K2CrO4混合液中滴加1×10﹣3molL﹣1 的AgNO3溶液,CrO42﹣先形成沉淀

