题目内容
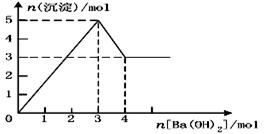
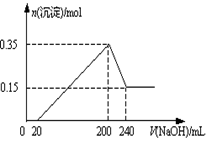
现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为( )
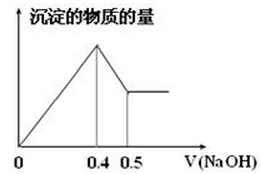

| A.1 :3 | B.2 :3 | C.6 :1 | D.3 :1 |
C
试题分析:第一条上升的直线是表示AlCl3和MgSO4一起产生沉淀,第二条下降的直线表示Al(OH)3沉淀溶解,设氢氧化钠溶液的浓度为c,由第二条直线可知加入0.1体积的NaOH将氢氧化铝完全溶解,可知AlCl3是0.1cmol,氯离子的量为0.3cmol,这些氯化铝完全沉淀消耗氢氧化钠0.3体积,再根据第一条直线可知,0.4-0.1×3=0.1体积的氢氧化钠将镁离子全部沉淀,而2NaOH~MgSO4,所以MgSO4为0.05cmol,所以硫酸根离子的量为0.05cmol,所以原溶液中Cl-与SO42-的物质的量之比为0.3cmol:0.05cmol=6:1,故选C。

练习册系列答案
相关题目
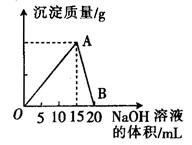
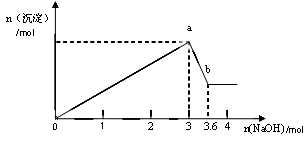
 b变化过程的离子方程式 。
b变化过程的离子方程式 。
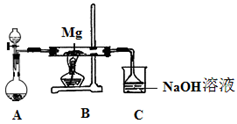
 2MgSO3+S;丙同学的推测是:3Mg+SO2
2MgSO3+S;丙同学的推测是:3Mg+SO2