题目内容
SiO2、SO2和CO2都是酸性氧化物,它们的化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性。某兴趣小组用如图所示装置进行Mg与SO2反应的实验。
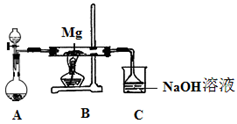
(1)选择制取SO2的合适试剂 (填编号)。
①浓HCl ②浓H2SO4 ③Na2SO3固体 ④CaSO3固体
(2)上述装置还可优化,优化的方法是 ,装置C中NaOH溶液的作用是 。
(3)甲同学推测Mg与SO2的反应与CO2相似,则该反应方程式为
;乙同学的推测是:2Mg+3SO2 2MgSO3+S;丙同学的推测是:3Mg+SO2
2MgSO3+S;丙同学的推测是:3Mg+SO2 2MgO+MgS,要验证甲、乙、丙三位同学的推测是否正确,丁同学作如下实验探究:
2MgO+MgS,要验证甲、乙、丙三位同学的推测是否正确,丁同学作如下实验探究:
已知:MgSO3和MgS都是微溶于水,能与盐酸发生复分解反应放出气体;H2S气体通入CuSO4溶液中出现黑色沉淀。
限选试剂:2mol/L HCl、2mol/L HNO3、蒸馏水、2mol/LNaOH、品红溶液、澄清石灰水、2mol/LCuSO4;仪器和用品自选。
根据上述实验探究,能证明甲同学推测正确的操作和预期现象是 。
(4)上述实验需要100mL,2mol/L的HCl,配制时选用 (选填10 mL、25 mL、50 mL或100 mL)量筒量取36.5%,密度1.19g/mL的浓盐酸的体积为 mL。(保留三位有效数字)

(1)选择制取SO2的合适试剂 (填编号)。
①浓HCl ②浓H2SO4 ③Na2SO3固体 ④CaSO3固体
(2)上述装置还可优化,优化的方法是 ,装置C中NaOH溶液的作用是 。
(3)甲同学推测Mg与SO2的反应与CO2相似,则该反应方程式为
;乙同学的推测是:2Mg+3SO2
 2MgSO3+S;丙同学的推测是:3Mg+SO2
2MgSO3+S;丙同学的推测是:3Mg+SO2 2MgO+MgS,要验证甲、乙、丙三位同学的推测是否正确,丁同学作如下实验探究:
2MgO+MgS,要验证甲、乙、丙三位同学的推测是否正确,丁同学作如下实验探究:已知:MgSO3和MgS都是微溶于水,能与盐酸发生复分解反应放出气体;H2S气体通入CuSO4溶液中出现黑色沉淀。
限选试剂:2mol/L HCl、2mol/L HNO3、蒸馏水、2mol/LNaOH、品红溶液、澄清石灰水、2mol/LCuSO4;仪器和用品自选。
| 序号 | 实验步骤 | 预期现象和结论 |
| ① | 取少量反应后所得固体于试管中 | |
| ② | 向试管中的固体慢慢滴加 , 试管口塞上带导管的单孔塞,并将导管通入盛有 的试管中。 | 若试管中的 , 则丙同学推测正确。 若试管中的固体未完全溶解,且 ,则乙同学推测正确。 |
(4)上述实验需要100mL,2mol/L的HCl,配制时选用 (选填10 mL、25 mL、50 mL或100 mL)量筒量取36.5%,密度1.19g/mL的浓盐酸的体积为 mL。(保留三位有效数字)
(16分)
(1)②③(2分)(有错不给分)
(2)在A和B之间增加用浓硫酸干燥的装置(2分);(或在B管药品下垫钢片也给2分)
(若有BC之间加用浓硫酸干燥的装置不算给分或扣分点,没有说明AB之间得0分)
吸收多余的SO2,防止污染环境(1分)
(只写其中一个就给1分,有错不给分)
(3)2Mg+SO2 2MgO+S(2分)
2MgO+S(2分)
(没写条件扣1分,条件可以写点燃,没有配平扣1分)
方案I
方案II
向反应后所得固体加过量2mol/L盐酸(写2mol/L硝酸不扣分)(给1分),固体未完全溶解且品红溶液不褪色(两个现象都对才给1分)(或反应后固体未完全溶解于盐酸且无气体产生(两个现象都对才给1分))(2分)
或者向反应后所得固体加过量2mol/LHCl(1分),固体未完全溶解且盛有2mol/LCuSO4的试管没有出现明显变化。(1分)前后答案不牵制,各得各的分
(4)25mL(1分)(有错不给分);16.8(16.7~17.0 都给2分,若只写17扣1分) (2分)
(1)②③(2分)(有错不给分)
(2)在A和B之间增加用浓硫酸干燥的装置(2分);(或在B管药品下垫钢片也给2分)
(若有BC之间加用浓硫酸干燥的装置不算给分或扣分点,没有说明AB之间得0分)
吸收多余的SO2,防止污染环境(1分)
(只写其中一个就给1分,有错不给分)
(3)2Mg+SO2
 2MgO+S(2分)
2MgO+S(2分)(没写条件扣1分,条件可以写点燃,没有配平扣1分)
方案I
| ② | 2mol/L 盐酸至过量(1分); (盐酸没写浓度、没有写过量或足量不给分) 品红(1分)(或品红溶液) | 固体完全溶解;(1分) (没有写完全不给分) (另加品红不褪色不算得分点) 品红溶液褪色(1分);(若只写品红也给分) |
方案II
| ② | 2mol/L 盐酸至过量(1分); 1~2ml(体积不算给分点)2mol/LCuSO4(1分) | 出现黑色沉淀;(1分)(没有写黑色不给分) 有刺激性气味的气体产生(1分); |
向反应后所得固体加过量2mol/L盐酸(写2mol/L硝酸不扣分)(给1分),固体未完全溶解且品红溶液不褪色(两个现象都对才给1分)(或反应后固体未完全溶解于盐酸且无气体产生(两个现象都对才给1分))(2分)
或者向反应后所得固体加过量2mol/LHCl(1分),固体未完全溶解且盛有2mol/LCuSO4的试管没有出现明显变化。(1分)前后答案不牵制,各得各的分
(4)25mL(1分)(有错不给分);16.8(16.7~17.0 都给2分,若只写17扣1分) (2分)
试题分析:(1)亚硫酸的酸性比硫酸弱,根据强制弱的复分解反应原理,Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,因此应选择浓硫酸和亚硫酸钠制取二氧化硫气体,不能选择亚硫酸钙,因为亚硫酸钙、硫酸钙都微溶于水;也不能选择浓盐酸,因为盐酸具有挥发性,产生的HCl、水蒸气对镁与二氧化硫的反应产物产生干扰;(2)上述装置缺少干燥装置,应在在A和B之间增加用浓硫酸干燥的装置;二氧化硫具有酸性氧化物的通性,容易与氢氧化钠溶液反应生成亚硫酸钠和水,从而吸收多余的二氧化硫、防止污染环境;(3)由于CO2(g)+4Na(g)
 2Na2O(s)+C(s,金刚石),则CO2+2Mg
2Na2O(s)+C(s,金刚石),则CO2+2Mg 2MgO+C,由此类比或仿写,则2Mg+SO2
2MgO+C,由此类比或仿写,则2Mg+SO2 2MgO+S;装置B中固体产物可能是MgO和S或MgSO3和S或MgO和MgS,根据物质性质及已知信息可知,单质硫是难溶于水的黄色固体,也不溶于盐酸或稀硝酸;氧化镁难溶于水,可溶于盐酸或硝酸;亚硫酸镁微溶于水,易溶于盐酸或硝酸,但前者反应产生二氧化硫气体,二氧化硫气体可用品红溶液检验,后者没有二氧化硫产生,而是产生一氧化氮;硫化镁微溶于水,易溶于盐酸或硝酸,前者反应生成硫化氢气体,硫化氢通入硫酸铜溶液产生黑色沉淀,后者不产生硫化氢,而是产生单质硫和一氧化氮气体;根据上述性质可以确定检验试剂,以及预期现象和结论,从而设计合理的实验方案;(4)先根据c?V=n求稀盐酸中溶质的物质的量,再根据n?M=m求稀溶液中溶质的质量,由于稀释前后溶质质量保持不变,然后根据溶质质量除质量分数可求浓盐酸的质量,最后根据浓溶液质量除以密度求浓盐酸的体积,即浓盐酸体积计算表达式=
2MgO+S;装置B中固体产物可能是MgO和S或MgSO3和S或MgO和MgS,根据物质性质及已知信息可知,单质硫是难溶于水的黄色固体,也不溶于盐酸或稀硝酸;氧化镁难溶于水,可溶于盐酸或硝酸;亚硫酸镁微溶于水,易溶于盐酸或硝酸,但前者反应产生二氧化硫气体,二氧化硫气体可用品红溶液检验,后者没有二氧化硫产生,而是产生一氧化氮;硫化镁微溶于水,易溶于盐酸或硝酸,前者反应生成硫化氢气体,硫化氢通入硫酸铜溶液产生黑色沉淀,后者不产生硫化氢,而是产生单质硫和一氧化氮气体;根据上述性质可以确定检验试剂,以及预期现象和结论,从而设计合理的实验方案;(4)先根据c?V=n求稀盐酸中溶质的物质的量,再根据n?M=m求稀溶液中溶质的质量,由于稀释前后溶质质量保持不变,然后根据溶质质量除质量分数可求浓盐酸的质量,最后根据浓溶液质量除以密度求浓盐酸的体积,即浓盐酸体积计算表达式=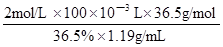 =16.8mL;根据量筒的使用方法,25mL规格量筒最接近16.8mL,因此应选择25mL规格。
=16.8mL;根据量筒的使用方法,25mL规格量筒最接近16.8mL,因此应选择25mL规格。
练习册系列答案
相关题目