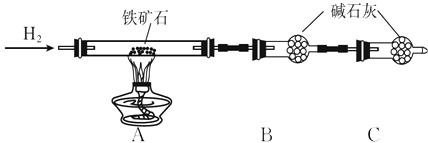
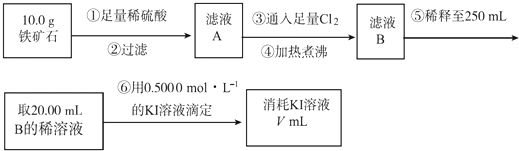
��Ŀ����
����Ŀ����������Ԫ��A��B��C��D��X��Y����ԭ��������������С��54��������A2B��Һ̬����ʳ������ҪӪ������֮һ���ߴ�C���ʾ������õİ뵼�����ܣ�D��X��Yԭ�Ӻ���������������Ϊ7������Ԫ��Z��B���γɶ��ֻ�������к���ɫ��ĩZ2B3��������ǽͿ�ϣ��밴Ҫ��ش��������⣺
��1����D2ˮ��Һ����dz��ɫ��ZD2��Һ�з�����Ӧ�����ӷ���ʽΪ �� ��ѧ������ΪX2��Y2�����ܽ�Z2+����ΪZ3+ �� �������������� ��
�ڶ�ѧ������ΪX2��Y2�����ܽ�Z2+����ΪZ3+��ѧ������ΪX2�ܽ�Z2+����ΪZ3+��Y2���ܣ�ѧ���ҡ��������������� ��
��2��A��B���γɼȺ����Լ��ֺ��Ǽ��Լ��Ļ�����W��W��ˮ��Һ�������ԣ�����������������ɱ�����ȣ���W�ĵ���ʽΪ �� W��һ�����뷽��ʽΪ ��
���������W��Һ��ˮ�к���Z3+ �� ������W������ɱ����������������ȫʧȥɱ�����ã����û�ѧ����ʽ������ԭ�� ��
��3��Ǧ��Pb��������Sn�����ࣨGe����Ԫ��Cͬ���壬ԭ�Ӻ�����Ӳ�����С��7���������䵥�ʣ��ڿ������������Ӧ����Ǧ���������һ������Ǧ�����������Ӧ�����������ᷴӦ���ɴ˿ɵó����½��ۣ������ԭ������Ϊ��
������+4����������ļ�����ǿ����˳��Ϊ���ѧʽ�� ��
���𰸡�
��1��Cl2+2Fe2+=2Cl��+2Fe3+��Cl��Br��I���ǵڢ�A��Ԫ�أ��䵥�ʵ������Ծ���ǿ��Cl��Br��I���ǵڢ�A��Ԫ�أ����϶��·ǽ����Լ������䵥�ʵ������Լ���
��2��![]() ��H2O2?H++HO2����2H2O2
��H2O2?H++HO2����2H2O2 ![]() 2H2O+O2��
2H2O+O2��
��3��32��Pb��OH��4��Sn��OH��4��Ge��OH��4
���������⣺��������Ԫ��A��B��C��D��X��Y����ԭ��������������С��54��������A2B��Һ̬����ʳ������ҪӪ�����ʣ�A2B��H2O����AΪ��Ԫ�أ�BΪ��Ԫ�أ��ߴ�C���ʾ������õİ뵼�����ܣ�CΪSiԪ�أ�D��X��Yԭ�Ӻ���������������Ϊ7�����ڵڢ�A�壬D����Ԫ�ز����ڣ���Y��ԭ������С��54����DΪClԪ�ء�XΪBrԪ�ء�YΪIԪ�أ�����Ԫ��Z��B���γɶ��ֻ�������к���ɫ��ĩZ2B3��������ǽͿ�ϣ�ZΪFeԪ�أ���1����Cl2ˮ��Һ����dz��ɫ��FeCl2��Һ�з�����Ӧ�����ӷ���ʽΪ��Cl2+2Fe2+=2Cl��+2Fe3+ �� ���Դ��ǣ�Cl2+2Fe2+=2Cl��+2Fe3+����ѧ������ΪX2��Y2�����ܽ�Z2+����ΪZ3+ �� ������������Ӧ�ǣ�Cl��Br��I���ǵڢ�A��Ԫ�أ��䵥�ʵ������Ծ���ǿ�����Դ��ǣ�Cl��Br��I���ǵڢ�A��Ԫ�أ��䵥�ʵ������Ծ���ǿ���ڶ�ѧ������ΪX2��Y2�����ܽ�Z2+����ΪZ3+��ѧ������ΪX2�ܽ�����Z2+ΪZ3+ �� ��Y2���ܣ�ѧ���ҡ��������������ǣ�Cl��Br��I���ǵڢ�A��Ԫ�أ����϶��·ǽ����Լ������䵥�ʵ������Լ��������Դ��ǣ�Cl��Br��I���ǵڢ�A��Ԫ�أ����϶��·ǽ����Լ������䵥�ʵ������Լ�������2��A��B���γɼȺ����Լ��ֺ��Ǽ��Լ��Ļ�����W��W��ˮ��Һ�������ԣ�����������������ɱ�����ȣ�WΪH2O2 �� ��H2O2����ԭ������ԭ��֮���γ�һ�Թ��õ��Ӷԣ���ԭ��֮���γ�1�Թ��õ��Ӷԣ��ʵ���ʽΪ ![]() ����ˮ��Һ�������ԣ�Ϊ������ʣ������H+��HO2�� �� ��W��һ�����뷽��ʽΪH2O2H++HO2�� �� ���Դ��ǣ�
����ˮ��Һ�������ԣ�Ϊ������ʣ������H+��HO2�� �� ��W��һ�����뷽��ʽΪH2O2H++HO2�� �� ���Դ��ǣ� ![]() ��H2O2H++HO2���� ���������W��Һ��ˮ�к���Fe3+ �� Fe3+��H2O2�ķֽ���������ã�������Ӧ2H2O2
��H2O2H++HO2���� ���������W��Һ��ˮ�к���Fe3+ �� Fe3+��H2O2�ķֽ���������ã�������Ӧ2H2O2 ![]() 2H2O+O2����������H2O2������ɱ����������������ȫʧȥɱ�����ã�
2H2O+O2����������H2O2������ɱ����������������ȫʧȥɱ�����ã�
���Դ��ǣ�2H2O2 ![]() 2H2O+O2������3�������ٹ�Ԫ�ص���һ���ڣ�����ԭ�������γ�18�������ԭ������Ϊ14+18=32�����Դ��ǣ�32����ͬ�������϶��½�������ǿ��������Խǿ������+4����������ļ���Խǿ���ʼ�����ǿ����˳��Ϊ��Pb��OH��4��Sn��OH��4��Ge��OH��4 �� ���Դ��ǣ�Pb��OH��4��Sn��OH��4��Ge��OH��4 ��
2H2O+O2������3�������ٹ�Ԫ�ص���һ���ڣ�����ԭ�������γ�18�������ԭ������Ϊ14+18=32�����Դ��ǣ�32����ͬ�������϶��½�������ǿ��������Խǿ������+4����������ļ���Խǿ���ʼ�����ǿ����˳��Ϊ��Pb��OH��4��Sn��OH��4��Ge��OH��4 �� ���Դ��ǣ�Pb��OH��4��Sn��OH��4��Ge��OH��4 ��