题目内容
17.将氢氧化铜和铜的混合物100g在空气中充分加热灼烧,发现灼烧后固体质量仍为100g,若将100g该混合物投入足量稀硫酸中,充分反应后过滤,得到固体的质量为W g.(1)写出灼烧时反应的化学方程式;
(2)求W的值.
分析 分析题给的条件可以知道:加热反应后所发生的反应为:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO质量增加,Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O,H2O变成气体放出,质量减少,由题意可知,生成的黑色物质与原混合物的质量相等,即原来的铜、氢氧化铜混合物变成了CuO,根据质量守恒定律结合题给条件分析,可以知道参加反应氧气的质量与生成水的质量相等,求出铜与氢氧化铜的质量之比;若将100g该混合物投入足量稀硫酸中,氧化铜溶解,铜不溶于稀硫酸,充分反应后过滤,得到固体是铜质量,可以据此解答该题.
解答 解:由题意可知:知道参加反应氧气的质量与生成水的质量相等,假设参加反应氧气的质量与生成水的质量都为ag
设原混合物中铜为x,原混合物中氢氧化铜的质量为y.
2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO
128 32
x ag
$\frac{128}{x}=\frac{32}{ag}$
x=4ag
Cu(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O
98 18
y ag
$\frac{98}{y}=\frac{18}{ag}$
y=$\frac{49}{9}$ag
所以原混合物中铜和氢氧化铜的质量比为4ag:$\frac{49}{9}$ag=36:49;若将100g该混合物投入足量稀硫酸中,氧化铜溶解,铜不溶于稀硫酸,充分反应后过滤,得到固体是铜质量,所以W=$\frac{36}{49+36}×100g$=42.3g,
(1)灼烧时反应的化学方程式为:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O,答:灼烧时反应的化学方程式为:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O;
(2)W=$\frac{36}{49+36}×100g$=42.3g,答:W的值为42.3g.
点评 本题主要考查学生运用质量守恒定律分析和解决问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案| A. |  属于芳香族化合物 属于芳香族化合物 | B. |  属于酚类化合物 属于酚类化合物 | ||
| C. |  属于脂环化合物 属于脂环化合物 | D. | CH3CH(CH3)2属于链状化合物 |
| A. | 煤的干馏 | B. | 石油裂解 | ||
| C. | 蛋白质中加入饱和NH4Cl析出晶体 | D. | 古代植物变成煤 |
| A. | NH4+、Ca2+、HCO3-、NO3- | B. | Na+、Mg2+、NO3-、CH3COO- | ||
| C. | MnO4-、Na+、K+、SO42- | D. | SO42-、Cl-、K+、Ba2+ |
| A. | 电离时能生成H+的化合物一定是酸 | |
| B. | 碱在电离时一定有OH-生成 | |
| C. | 因为硫酸由H+和SO42-构成,故电离时能生成H+和SO42- | |
| D. | 氢氧化钠在水溶液中和熔化时都能发生电离 |
| A. | 溶液质量 | B. | 溶液密度 | C. | 溶液体积 | D. | 溶质质量 |
| A. | 放电时,电流由Pb流向PbO2 | B. | 放电时,Pb发生氧化反应 | ||
| C. | 充电时,在阴极区pH下降 | D. | 充电时,在阳极上PbSO4转化为Pb |
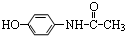 ,则有关它的性质错误的是( )
,则有关它的性质错误的是( )| A. | 与氢氧化钠溶液共热消耗2molNaOH | B. | 能与浓溴水发生取代反应 | ||
| C. | 不能使酸性高锰酸钾溶液褪色 | D. | 遇三氯化铁溶液呈现紫色 |