题目内容
将4mol A气体和2mol B气体在2L的密闭容器内混合,并在一定条件下发生如下反应:2A(g)+B(g) 2C(g),若经2s后测得C的浓度为0.6mol·L-1,现有下列几种说法:
2C(g),若经2s后测得C的浓度为0.6mol·L-1,现有下列几种说法:
①用物质A表示的反应的平均速率为0.3mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7mol·L-1
其中正确的是
 2C(g),若经2s后测得C的浓度为0.6mol·L-1,现有下列几种说法:
2C(g),若经2s后测得C的浓度为0.6mol·L-1,现有下列几种说法:①用物质A表示的反应的平均速率为0.3mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7mol·L-1
其中正确的是
| A.①③ | B.①④ | C.②③ | D.③④ |
B
试题分析:根据化学反应速率等于单位时间内浓度的变化量及根据反应2A(g)+B(g)
 2C(g),并利用三段式法计算。
2C(g),并利用三段式法计算。起始A的浓度为4mol÷2L=2mol/L
B的浓度为2mol÷2L=1mol/L
2A(g)+B(g)
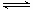 2C(g)
2C(g)起始浓度(mol/L) 2 1 0
转化浓度(mol/L) 0.6 0.3 0.6
2s时浓度(mol/L) 1.4 0.7 0.6
则2s内,用物质A表示的反应的平均速率为v(A)=0.6mol/L÷2s=0.3mol?L-1?s-1;
2s内,用物质B表示的反应的平均速率为v(B)=0.3mol/L÷2s=0.15mol?L-1?s-1;
2s时物质A的转化率为α=

2s时物质B的浓度为0.7mol?L-1,显然①④正确,所以答案选B。
点评:在进行可逆反应的有关计算时,一般采用“三段式”进行,即分别列出起始量、转化量和平衡量或某时刻的量,然后依据已知条件列式计算即可,有利于培养学生的规范答题能力。

练习册系列答案
 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案
相关题目
 CH3OH(g)+H2O(g) ΔH =-49.0 kJ·mol-1
CH3OH(g)+H2O(g) ΔH =-49.0 kJ·mol-1
 N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol
N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol 2SO3,该反应正反应是放热反应,下列说法不正确的是( )
2SO3,该反应正反应是放热反应,下列说法不正确的是( ) CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol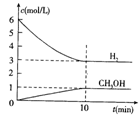
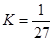 ,CO2和H2的转化率相等
,CO2和H2的转化率相等 y C(g); △H <0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:
y C(g); △H <0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题: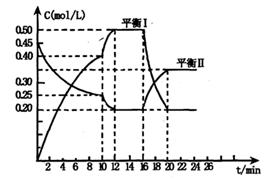
 CH3OCH3(g) + H2O(g) 的平衡常数为400。此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度为表中相应的数据。下列说法正确的是
CH3OCH3(g) + H2O(g) 的平衡常数为400。此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度为表中相应的数据。下列说法正确的是 H2+I2
H2+I2