题目内容
向某密闭容器中加入0.15mol/L A、0.05mol/L C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如下图中甲图所示[t0时c( B)未画出,t1时增大到0.05mol/L]。乙图为 t2时刻后改变反应条件,平衡体系中正、逆反应速率随时间变化的情况。
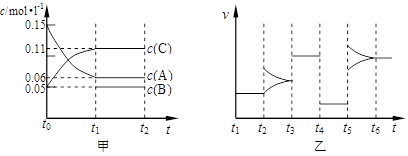
(1)若t4时改变的条件为减小压强,则B的起始物质的量浓度为 mol/L;
该反应的平衡常数表达式为K= 。
(2)若t5时改变的条件是升温,此时v(正) > v(逆),平衡常数K的值将 (选填“增大”、“减小”或“不变”)。
(3)若 t1= 15s,则t0~ t1阶段以C 浓度变化表示的平均反应速率为v(C)=
mol/L·s。t3时改变的某一反应条件可能是 (选填序号)。
a.使用催化剂 b.增大压强 c.增大反应物浓度 d.降低产物浓度
(4)若A的物质的量减少0.02mol时,容器与外界的热交换总量为a kJ,写出该反应的热化学方程式 。

(1)若t4时改变的条件为减小压强,则B的起始物质的量浓度为 mol/L;
该反应的平衡常数表达式为K= 。
(2)若t5时改变的条件是升温,此时v(正) > v(逆),平衡常数K的值将 (选填“增大”、“减小”或“不变”)。
(3)若 t1= 15s,则t0~ t1阶段以C 浓度变化表示的平均反应速率为v(C)=
mol/L·s。t3时改变的某一反应条件可能是 (选填序号)。
a.使用催化剂 b.增大压强 c.增大反应物浓度 d.降低产物浓度
(4)若A的物质的量减少0.02mol时,容器与外界的热交换总量为a kJ,写出该反应的热化学方程式 。
(1)0.02 mol/L; (1分) K=[ B] ·[ C]2/ [ A]3(1分)
(2)增大 (1分)
(3)0.004mol/L·s (1分) ; a、 b (2分)
(4)3A (g) 2C(g) + B(g) -150akJ (2分)
2C(g) + B(g) -150akJ (2分)
(2)增大 (1分)
(3)0.004mol/L·s (1分) ; a、 b (2分)
(4)3A (g)
 2C(g) + B(g) -150akJ (2分)
2C(g) + B(g) -150akJ (2分)试题分析:
(1)根据甲图物质的变化量之比,可知A、C的计量数之比为3:2 ,t4时改变的条件为减小压强,但平衡不移动,说明左右两边气体分子数相同,因此B为生成物,系数为1,则起始浓度0.02 mol/L; 平衡常数表达式为K=[ B] ·[ C]2/ [ A]3。
(2)升温平衡正移,说明反应正向吸热,平衡常数K的值增大。
(3)v(C)= △c(C)/ △t=0.004mol/L·s ; t3时改变的某一反应条件,正逆反应速率增大,平衡不移动,只有a、 b 符合。
(4)A的物质的量减少0.02mol时,容器与外界的热交换总量为a kJ,减少3mol时:
3A (g)
 2C(g) + B(g) -150akJ 。
2C(g) + B(g) -150akJ 。
练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
 CH3OH(g)+Q
CH3OH(g)+Q 
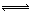 Z(g)
Z(g) n Z (g) △H > 0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。下列说法不正确的是
n Z (g) △H > 0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。下列说法不正确的是


 3F+2G,用传感器测得该反应在不同pH条件下,物质D的浓度(用每升溶液所含溶质的质量表示,单位为mg/L)变化如图所示,下列有关说法正确的是
3F+2G,用传感器测得该反应在不同pH条件下,物质D的浓度(用每升溶液所含溶质的质量表示,单位为mg/L)变化如图所示,下列有关说法正确的是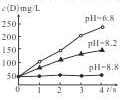

 N
N 2C(g),若经2s后测得C的浓度为0.6mol·L-1,现有下列几种说法:
2C(g),若经2s后测得C的浓度为0.6mol·L-1,现有下列几种说法: