题目内容
【题目】工业上可以利用水煤气(H2、CO)合成二甲醚(CH3OCH3),同时生成CO2。
2H2(g)+ CO(g)==CH3OH(g) △H=-91.8kJ/mol
2CH3OH(g)==CH3OCH3 (g)+H2O(g) △H=-23.5 kJ/mol
CO(g)+ H2O(g)==CO2(g)+H2(g) △H=-41.3 kJ/mol
下列说法不正确的是
A. CH3OH和乙醇均可发生消去反应
B. CH3OCH3中只含有极性共价键
C. 二甲醚与乙醇互为同分异构体
D. 水煤气合成二甲醚的热化学方程式:3H2(g)+3CO(g)===CH3OCH3 (g)+ CO2(g) △H=-248.4kJ/mol
【答案】A
【解析】A项,CH3OH中只有1个碳原子,不能发生消去反应,错误;B项,CH3OCH3中化学键有C-H、C-O,C-H、C-O都是极性共价键,正确;C项,二甲醚和乙醇的分子式都是C2H6O,结构不同,两种互为同分异构体,正确;D项,将题给3个热化学方程式依次编号为①式、②式、③式,应用盖斯定律,①式![]() 2+②式+③式,得3H2(g)+3CO(g)=CH3OCH3(g)+CO2(g)ΔH=(-91.8kJ/mol)
2+②式+③式,得3H2(g)+3CO(g)=CH3OCH3(g)+CO2(g)ΔH=(-91.8kJ/mol)![]() 2+(-23.5kJ/mol)+(-41.3kJ/mol)=-248.4kJ/mol,正确;答案选A。
2+(-23.5kJ/mol)+(-41.3kJ/mol)=-248.4kJ/mol,正确;答案选A。

 智慧小复习系列答案
智慧小复习系列答案【题目】卤块的主要成分是MgCl2 , 此外还含Fe3+、Fe2+和Mn2+等离子.若以它为原料按下图所示工艺流程进行生产,可制得轻质氧化镁.
若要求产品尽量不含杂质,而且生产成本较低,根据表1和表2提供的资料,填写空白:
表1生成氢氧化物沉淀的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH)2 | 9.6 | 11.1 |
Fe2+氢氧化物呈絮状,不易从溶液中除去,常将它氧化为Fe3+ , 生成Fe(OH)3沉淀除去.
表2原料价格表
物质 | 价格/元吨﹣1 |
漂液(含25.2%NaClO) | 450 |
双氧水(含30%H2O2) | 2400 |
烧碱(含98%NaOH) | 2100 |
纯碱(含99.5%Na2CO3) | 600 |
(1)在步骤②中加入的试剂X,最佳的选择是 , 其作用是;
(2)在步骤③中加入的试剂应是;之所以要控制pH=9.8,其目的是;
(3)在步骤④中加入的试剂Z应是;
(4)在步骤⑤中发生的反应是 .
【题目】海水资源的利用具有广阔前景。海水中主要离子的含量如下:
成分 | 含量/(mg·L-1) | 成分 | 含量/(mg·L-1) |
Cl- | 18980 | Ca2+ | 400 |
Na+ | 10560 | HCO3- | 142 |
SO42- | 2560 | Br- | 64 |
Mg2+ | 1272 |
(1)电渗析法淡化海水示意图如下图所示;其中阴(阳)离子交换膜仅允许阴(阳)离子通过。
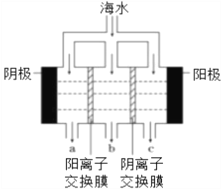
①阳极主要电极反应式是____________。
②在阴极附近产生少量白色沉淀,两种主要的成分为____________。
③淡水的出口为_______(填“a”、“b”或“c”)。
(2)利用海水可以提取溴和镁,提取过程如下:

①从MgCl2·6H2O晶体得到无水MgCl2的主要实验操作是_______________。
②依据上述流程,若将0.5m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为_________L(忽略Cl2溶解)。