题目内容
7. (1)1mol氢气在氯气中充分燃烧生成氯化氢气体时放出184.6kJ的热量,试写出对应的热化学方程式H2(g)+Cl2(g)=2HCl(g)△H=-184.6 kJ•mol-1.标准状况下11.2L氢气在氯气中充分燃烧放出的热量是92.3kJ.
(1)1mol氢气在氯气中充分燃烧生成氯化氢气体时放出184.6kJ的热量,试写出对应的热化学方程式H2(g)+Cl2(g)=2HCl(g)△H=-184.6 kJ•mol-1.标准状况下11.2L氢气在氯气中充分燃烧放出的热量是92.3kJ.(2)A(g)+B(g)?C(g)+D(g)过程中的能量(kJ)变化如图所示,回答下列问题.
①反应物A(g)和B(g)具有的总能量大于(填大于、小于、等于)生成物C(g)和D(g)具有的总能量.
②该反应是放热反应(填吸热、放热),△H=E1-E2(用E1和E2表示)
分析 (1)依据热化学方程式的书写原则和注意问题写出,标注聚集状态和焓变,标准状况下11.2L氢气物质的量=$\frac{11.2L}{22.4L/mol}$=0.5mol,结合热化学方程式计算;
(2)△H=生成物能量和-反应物能量和,从图象可见,反应物的能量低于生成物,反应吸热,据此分析.
解答 解:(1)1mol氢气在氯气中充分燃烧生成氯化氢气体时放出184.6kJ的热量,对应的热化学方程式为:H2(g)+Cl2(g)=2HCl(g)△H=-184.6 kJ•mol-1,标准状况下11.2L氢气物质的量=$\frac{11.2L}{22.4L/mol}$=0.5mol,反应放热=184.6 kJ•mol-1×0.5mol=92.3KJ,
故答案为:H2(g)+Cl2(g)=2HCl(g)△H=-184.6 kJ•mol-1;92.3;
(2)①反应物的能量高于生成物,1mol气体A和1mol气体B具有的能量比1mol气体C和1mol气体D具有的总能量一定高,故答案为:大于;
②△H=生成物能量和-反应物能量和<0,反应放热,△H=反应物活化能-生成物活化能=(E1-E2)kJ/mol,故答案为:放热;(E1-E2).
点评 本题通过图象分析反应放热还是吸热与反应物生成物能量高低的关系,以及通过活化能计算焓变的方法,题目难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
7.下列电子式书写正确的是( )
| A. | CCl4  | B. | 氯化镁 | ||
| C. | 氮气 | D. | 水 |
2.已知某芳香族化合物A,其分子式为C7H6O2,又知A在一定条件下能与新制氢氧化铜悬浊液反应,则符合上述条件的A有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
12.在一定条件下,等物质的量的乙烯和苯分别和足量氢气发生加成反应,消耗氢气的物质的量之比为( )
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 1:4 |
19.同温、同压下等质量的SO2气体和CO2气体,下列有关比较的叙述中不正确的是( )
| A. | 物质的量比为11:16 | B. | 密度比为16:11 | ||
| C. | 体积比为16:11 | D. | 体积比为11:16 |
16.放射性核素12553I可用于治肿瘤,下列关于12553I的叙述正确的是( )
| A. | 12553I 原子核内中子数为53 | |
| B. | 12553I原子核外电子数为72 | |
| C. | 12553I 和12753I互为同位素 | |
| D. | 12553I代表有53个质子和125个中子的碘原子 |
17.关于12C18O 和14N2两种气体,下列说法正确的是( )
| A. | 若体积相等,则密度相等 | B. | 若质量相等,则质子数相等 | ||
| C. | 若分子数相等,则体积相等 | D. | 若原子数相等,则电子数相等 |
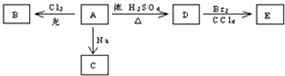 化合物A(C4H10O)是一种有机溶剂.A可以发生如图变化:
化合物A(C4H10O)是一种有机溶剂.A可以发生如图变化: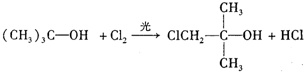 .
. .
.