题目内容
一定条件下,在一固定容积的密闭容器中发生如下反应:N2(g)+3H2(g) 2NH3(g),若开始时只充入2a mol NH3,达到平衡时,混合气体的压强比起始时增大了40%。若同条件下开始时充入a mo N2和3a mol H2的混合气体,求:
2NH3(g),若开始时只充入2a mol NH3,达到平衡时,混合气体的压强比起始时增大了40%。若同条件下开始时充入a mo N2和3a mol H2的混合气体,求:
(1)达到平衡时H2的转化率;
(2)平衡时NH3在混合气体中的体积分数。
一定条件下,在一固定容积密闭容器中发生如下反应:N2(g)+3H2(g) 2NH3(g),若开始时只充入2a mol NH3,达到平衡时,混合气体的压强比起始时增大了40%。若开始时充入a mo N2和3a mol H2的混合气体,求:
2NH3(g),若开始时只充入2a mol NH3,达到平衡时,混合气体的压强比起始时增大了40%。若开始时充入a mo N2和3a mol H2的混合气体,求:
(1)达到平衡时H2的转化率;
(2)平衡时NH3在混合气体中的体积分数。
(1)60%; (2)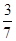 (或42.9%)
(或42.9%)
解析试题分析:(1)N2 (g)+3H2(g)  2NH3 (g)
2NH3 (g)
起始量(mol) 0 0 2a
转化量(mol) x 3x 2x
平衡量(mol) x 3x (2a-2x)
所以根据题意可知 =1.4
=1.4
解得x=0.4a
若开始时充入a mol N2和3a mol H2的混合气体,达到平衡时,与开始充入2a mol NH3平衡等效
所以反应的H2的物质的量为:3a-3x=3a-3×0.4a=1.8a mol
所以H2的转化率为 ×100% =60%
×100% =60%
(2)NH3在混合气体中的体积分数: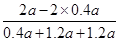 =
=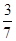 (或42.9%)
(或42.9%)
考点:考查可逆反应的有关计算以及等效平衡的应用

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应C(s)+H2O(g) CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g) 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
| A.①④ | B.①②③ | C.②③④ | D.①②③④ |
可逆反应A(?)+aB(g)  C(g)+2D(g)(a为正整数)。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图所示。下列说法不正确的是
C(g)+2D(g)(a为正整数)。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图所示。下列说法不正确的是
| A.若a=2,则A为液态或固体 |
| B.该反应的正反应为放热反应 |
| C.T2>T1,P2>P1 |
| D.其他条件不变,增加B的物质的量,平衡正向移动,平衡常数K增大 |
下列有关说法正确的是
| A.合成氨反应需使用催化剂,说明催化剂可以促进该平衡向生成氨的方向移动 |
| B.铅蓄电池在放电过程中,负极质量增加,正极质量减少 |
| C.100 mL pH=3的HA溶液、HB溶液分别与足量的锌反应,HA溶液放出的氢气多,说明HA的酸性比HB的弱 |
D.已知I3- I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 |
 C+2 D(a为化学计量数),已知B、C、D为气态物质。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是
C+2 D(a为化学计量数),已知B、C、D为气态物质。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是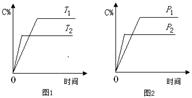

 pC(g)+qD(g) △H<0。下列结论中错误的是
pC(g)+qD(g) △H<0。下列结论中错误的是 2C(g)一段时间后达到平衡,生成n mol C。则下列说法中不正确的是( )
2C(g)一段时间后达到平衡,生成n mol C。则下列说法中不正确的是( ) )
)