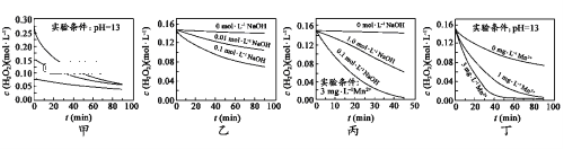
题目内容
【题目】下列有关电解质溶液的说法正确的是
A. 向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中![]() 减小
减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C. 向盐酸中加入氨水至中性,溶液中![]()
D. NH4HSO4和NaOH混合呈中性C(Na+)>C(SO42—)>C(NH4+)>C(NH3·H2O)>C(H+)=C(OH—)
【答案】D
【解析】
A项,Ka=![]() ,加水虽然促进电离,n(CH3COO-)增大,但c(CH3COO-)减小,Ka保持不变,而且醋酸电离氢离子浓度和醋酸根完全一致,但是由于氢离子的减小导致水电离的氢离子浓度变大,故A项错误;
,加水虽然促进电离,n(CH3COO-)增大,但c(CH3COO-)减小,Ka保持不变,而且醋酸电离氢离子浓度和醋酸根完全一致,但是由于氢离子的减小导致水电离的氢离子浓度变大,故A项错误;
B项,20℃升温至30℃,促进CH3COO-水解,且Kh增大,则溶液中![]() =
=![]() 减小,故B项错误;
减小,故B项错误;
C项,向盐酸中加入氨水至中性,则c(H+)=c(OH﹣),由电荷守恒可知,溶液中c(NH4+)=c(Cl-),即![]() ,故C项错误。
,故C项错误。
D项,反应中氢氧化钠的量和硫酸氢铵1:1时,溶液为硫酸铵:硫酸钠=1:1,溶液为酸性,题干中溶液中性,c(H+)=c(OH﹣),故氢氧化钠过量,且反应后溶液中的溶质为硫酸钠、硫酸铵、一水合氨,且铵根离子水解程度等于一水合氨电离程度,反应后c(Na+)>c(SO42—)>c(NH4+)>c(NH3·H2O)>c(H+)=c(OH—),故D项正确。
综上所述,本题正确答案为D。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案【题目】Bodensteins研究了下列反应:2HI(g)![]() H2(g)+I2(g)
H2(g)+I2(g)![]() 。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示。当升高温度,再次达到平衡时,v正 v逆可能落在A、B、C、D、E哪些点。
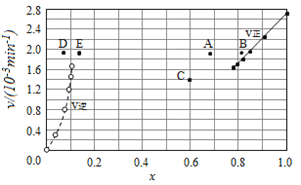
A. A D B. B D C. B E D. A E