题目内容
【题目】在下图所示的物质转化关系中,A是常见的气态氢化物,B是能使带火星的木条复燃的无色无味气体,E的相对分子质量比D大17,G是一种紫红色金属单质。(部分反应中生成物没有全部列出,反应条件未列出)

请回答下列问题:
(1)A的化学式为_____。B的化学式为________。
(2)反应①的化学方程式为_________。
(3)反应②的离子方程式为_______。
【答案】NH3 O2 3NO2+H2O=2HNO3+NO 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
【解析】
根据物质的性质及物质间的转化关系分析各物质的组成,书写相关反应方程式。
B是能使带火星的木条复燃的无色无味气体,则B是氧气。G是一种紫红色金属单质,则G是铜.A是常见气态氢化物,且能和氧气反应,所以根据图中的转化课判断,A可能是氨气,则C就是NO,F是水。NO和氧气反应生成NO2,NO2溶于水生成硝酸,则E是硝酸,硝酸和铜反应又生成NO;
(1)由以上分析可知A为氨气,B为氧气,故答案为: NH3;O2;
(2)反应①为二氧化氮与水生成硝酸的反应,方程式为:3NO2+H2O=2HNO3+NO;
(3)反应②为铜和稀硝酸的反应,反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。

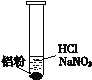
【题目】一位同学在复习时遇到这样一道习题:某无色溶液中可能含有“H+、OH-、Na+、NO3-”,加入铝粉后,只产生H2,问该无色溶液中能大量存在哪几种离子。
(1)加入铝粉产生H2,说明铝具有__________(填“氧化性”或“还原性”)。
(2)该同学若H+大量存在,则NO3-就不能大量存在。设计实验证实如下:
装 置 | 现 象 |
| ⅰ. 实验初始,未见明显现象 ⅱ. 过一会儿,出现气泡,液面上方呈浅棕色 ⅲ. 试管变热,溶液沸腾 |
①盐酸溶解Al2O3薄膜的离子方程式是_______________________________。
②根据现象ⅱ,推测溶液中产生了NO,为进一步确认,进行如下实验:
实验 | 内容 | 现象 |
实验1 | 将湿润KI—淀粉试纸置于空气中 | 未变蓝 |
实验2 | 用湿润KI—淀粉试纸检验浅棕色气体 | 试纸变蓝 |
a.浅棕色气体是____________。
b.实验1的目的是_______________________________。
c.实验1、2说明反应生成了NO,将生成NO的离子方程式补充完整:
______Al +______NO3-+_____ _ ==______Al 3++______NO+______ ,_______
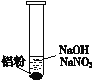
(3)再假设:若OH-大量存在,NO3-也可能不能大量存在。重新设计实验证实如下:
装 置 | 现 象 |
| ⅰ. 实验初始,未见明显现象 ⅱ. 过一会儿,出现气泡,有刺激性气味 |
为确认“刺激性气味”气体,进行如下实验:用湿润KI—淀粉试纸检验,未变蓝;用湿润红色石蕊试纸检验,试纸变蓝。
①刺激性气味的气体是____________。
②产生该气体的离子方程式是____________________________________。
(4)在NaOH溶液中加入铝粉,结果只检验出有H2生成,其化学方程式是_________________________________。
(5)实验结果证实:NO3-在酸、碱性环境中都有一定的氧化性,能氧化铝单质,产生含氮化合物。试题中的无色溶液一定能大量存在的是_______________。
【题目】下列各组物质除杂和分离方法正确的是( )
被提纯物质 | 除杂试剂 | 分离方法 | |
A | 苯(苯甲酸) | 生石灰 | 蒸馏 |
B | 乙酸乙酯(乙酸) | 氢氧化钠溶液 | 分液 |
C | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
D | 苯(苯酚) | 浓溴水 | 过滤 |
A.AB.BC.CD.D