题目内容
【题目】25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgc(M2+)]与溶液pH的变化关系如图所示,已知该温度下Ksp[Cu(OH)2]<Ksp[Fe(OH)2]。下列说法正确的是( )
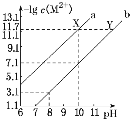
A.曲线a表示Fe(OH)2饱和溶液中的变化关系
B.除去CuSO4溶液中含有的少量Fe2+,可加入适量CuO
C.当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中c(Cu2+)∶c(Fe2+)=1∶104.6
D.向X点对应的饱和溶液中加入少量NaOH固体,可转化为Y点对应的溶液
【答案】C
【解析】
A. 难溶物Fe(OH)2和Cu(OH)2的构型相同,当溶液pH相同时,溶液中c(OH-)相同,固体物质的溶度积常数越小,其相应的金属阳离子浓度越小,离子浓度的负对数就越大。由于该温度下Ksp[Cu(OH)2]<Ksp[Fe(OH)2],所以c(Cu2+)<c(Fe2+),离子浓度负对数:Cu2+>Fe2+,故曲线a表示Cu(OH)2饱和溶液中的变化关系,曲线b表示Fe(OH)2饱和溶液中的变化关系,A错误;
B. 该温度下Ksp[Cu(OH)2]<Ksp[Fe(OH)2],Cu(OH)2更容易形成沉淀,所以向含有少量Fe2+的CuSO4溶液中加入适量CuO,不能形成Fe(OH)2沉淀,因而不能除去Fe2+,B错误;
C. 当溶液pH=10时,c(OH-)=10-4,此时溶液中c(Cu2+)=10-11.7,c(Fe2+)=10-7.1,溶液中c(Cu2+)∶c(Fe2+)=10-11.7:10-7.1=1∶104.6,C正确;
D. 向X点对应的饱和溶液中加入少量NaOH固体,反应产生Cu(OH)2沉淀,使溶液中c(Cu2+)降低,而根据图示可知从X点到Y点对应的溶液中金属离子浓度不变,D错误;
故合理选项是C。