题目内容
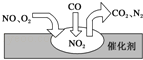
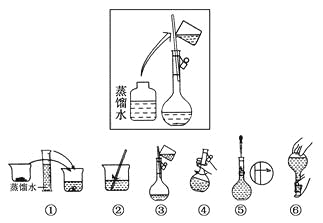
【题目】某同学设计如图装置,研究非金属元素性质变化规律。
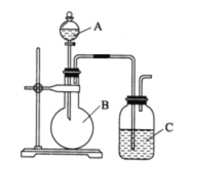
已知:高锰酸钾在常温下与浓盐酸反应产生氯气,离子方程式为______。
(1)如果C中装饱和的H2S溶液,A中装浓盐酸,B中装高锰酸钾溶液,反应开始后观察到现象是C中产生淡黄色沉淀,证明氯的非金属性比硫的非金属性________(填“强”或“弱”或“无法判断”;请用电子式表示H2S的形成过程:_____。
(2)利用如图装置证明Cl2氧化性强于I2的氧化性。则A中装浓盐酸,B中装入高锰酸钾粉末, C中装入淀粉KI溶液,则C中现象是______。
(3)现有浓硝酸、大理石、澄清石灰水、硅酸钠溶液,选择试剂用如图装置证明:非金属性:N > C > Si。C中装试剂______,实验现象为_________该装置存在不足之处,改进措施为:____。
【答案】2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O 强 ![]() 淀粉-KI溶液显蓝色 硅酸钠 有白色沉淀生成 在B、C间增加盛有饱和碳酸氢钠溶液的洗气瓶
淀粉-KI溶液显蓝色 硅酸钠 有白色沉淀生成 在B、C间增加盛有饱和碳酸氢钠溶液的洗气瓶
【解析】
高锰酸钾在常温下与浓盐酸反应产生氯气、氯化锰、氯化钾和水;
(1)根据氧化剂的氧化性比氧化产物强判断;
(2)装置C中,氯气与碘化钾反应生成氯化钾和碘;
(3)根据非金属的非金属性越强,其最高价氧化物对应的水化物的酸性越强;硝酸易挥发,则在B、C间增加吸收硝酸的装置;
高锰酸钾在常温下与浓盐酸反应产生氯气、氯化锰、氯化钾和水,反应的离子方程式为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(1)生成的氯气与硫化氢反应生成单质硫和氯化氢,氯气为氧化剂,S为氧化产物,则氯的非金属性比硫的强;用电子式表示H2S的形成过程为![]() ;
;
(2)装置C中,氯气与碘化钾反应生成氯化钾和碘,淀粉溶液遇到碘显蓝色;
(3)根据非金属的非金属性越强,其最高价氧化物对应的水化物的酸性越强,则酸性:硝酸>碳酸>硅酸,可证明非金属性:N > C > Si,则装置C中二氧化碳与硅酸钠反应生成硅酸,因硝酸易挥发,则在B、C间应增加一个吸收硝酸的装置,答案为硅酸钠;有白色沉淀生成;在B、C间增加盛有饱和碳酸氢钠溶液的洗气瓶;

【题目】(10分)某同学帮助水质检测站配制480 mL 0.5 mol·L-1NaOH溶液以备使用。
(1)该同学应选择________mL的容量瓶。
(2)其操作步骤如下图所示,
则如图操作应在下图中的________(填选项字母)之间。
A.②与③ B.①与② C.④与⑤
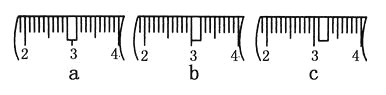
(3)该同学应称取NaOH固体________g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小________(填字母),并在下图中选出能正确表示游码位置的选项________(填字母)。
附表 砝码规格
a | b | c | d | e | |
砝码大小/g | 100 | 50 | 20 | 10 | 5 |
(4)下列操作对所配溶液的浓度大小有何影响?
①转移完溶液后未洗涤玻璃棒和烧杯,浓度会________(填“偏大”、“偏小”或“无影响”,下同)
②容量瓶中原来有少量蒸馏水,浓度会________。
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)表中元素原子半径最大的是(写元素符号)___,Y原子的电子排布式是__,Z原子核外电子能量最高的电子亚层是___。
(2)下列事实能说明Y元素的非金属性比S元素强的是___;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1mol Y单质比1mol S得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(3)CCl4是一种常见的有机溶剂,写出其电子式___,判断其属于含有___(填“极性”、“非极性”)共价键的____分子(填“极性”或“非极性”)。SiH4的沸点比CH4高,原因是___。
(4)碳酸钠溶液中滴入酚酞,溶液显红色,请用离子方程式说明产生该现象的原因:___,在上述红色的溶液中加入少许氯化钙固体,溶液颜色变浅,请用平衡理论解释产生该现象的原因____。