题目内容
(2011?濮阳二模)据报到,目前我国结核病的发病率有升高的趋势.抑制结核杆菌的药物除雷米封外,PAS-Na(对氨基水杨酸钠)也是其中一种.它与雷米封同时服用,可以产生协同作用.已知:①核磁共振氢谱可以证明化合物B有三种不同环境的氢
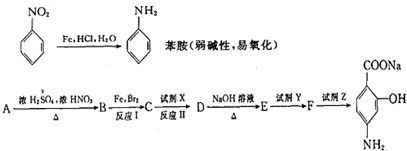
右面是PAS-Na的一种合成路线:
请回答下列问题:
(1)A的结构简式
 ;
;
(2)写出反应方程式:B→C:
 F→PAS-Na:
F→PAS-Na: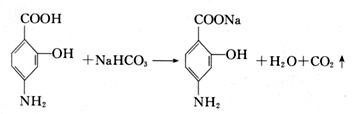
 ;
;
(3)指出反应类型:I
(4)①上述转化中试剂X,Y和试剂Z分别是:试剂X
a.Fe,HCl,H2O b.KMnO4(H+)c.NaHCO3溶液d.CO2
②若上述转化物质C依次与试剂Y、NaOH溶液、试剂X作用,能否得到F,为什么?
(5)写出同时符合下列要求的F的同分异构体的结构简式.
①属于芳香族化合物,分子中有两个取代基;②与FeCl3溶液能发生显色反应③含有一个硝基.

右面是PAS-Na的一种合成路线:
请回答下列问题:
(1)A的结构简式
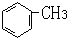
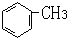
(2)写出反应方程式:B→C:




(3)指出反应类型:I
取代反应
取代反应
,II氧化反应
氧化反应
;(4)①上述转化中试剂X,Y和试剂Z分别是:试剂X
b
b
;试剂Ya
a
试剂Zc
c
;(选填字Y母)a.Fe,HCl,H2O b.KMnO4(H+)c.NaHCO3溶液d.CO2
②若上述转化物质C依次与试剂Y、NaOH溶液、试剂X作用,能否得到F,为什么?
(5)写出同时符合下列要求的F的同分异构体的结构简式.
①属于芳香族化合物,分子中有两个取代基;②与FeCl3溶液能发生显色反应③含有一个硝基.
分析:由对氨基水杨酸钠的结构可知A应为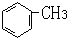 ,与浓硝酸,在浓硫酸、加热条件下发生硝化反应生成B,B有三种不同环境的氢,应发生对位取代,则B为
,与浓硝酸,在浓硫酸、加热条件下发生硝化反应生成B,B有三种不同环境的氢,应发生对位取代,则B为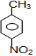 ,B与溴在Fe作催化剂条件下发生取代反应生成C,由对氨基水杨酸钠的结构可知,应发生甲基的邻位取代,故C为
,B与溴在Fe作催化剂条件下发生取代反应生成C,由对氨基水杨酸钠的结构可知,应发生甲基的邻位取代,故C为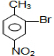 ,由于酚羟基、氨基易被氧化,故生成D的反应应为氧化反应,C被酸性高锰酸钾氧化生成D,则D为
,由于酚羟基、氨基易被氧化,故生成D的反应应为氧化反应,C被酸性高锰酸钾氧化生成D,则D为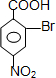 ,D在碱性条件下水解生成E为
,D在碱性条件下水解生成E为 ,E在Fe、HCl、水条件下发生还原生成F为,则F为
,E在Fe、HCl、水条件下发生还原生成F为,则F为 ,F与碳酸氢钠反应生成氨基水杨酸钠,以此解答该题.
,F与碳酸氢钠反应生成氨基水杨酸钠,以此解答该题.
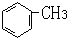 ,与浓硝酸,在浓硫酸、加热条件下发生硝化反应生成B,B有三种不同环境的氢,应发生对位取代,则B为
,与浓硝酸,在浓硫酸、加热条件下发生硝化反应生成B,B有三种不同环境的氢,应发生对位取代,则B为 ,B与溴在Fe作催化剂条件下发生取代反应生成C,由对氨基水杨酸钠的结构可知,应发生甲基的邻位取代,故C为
,B与溴在Fe作催化剂条件下发生取代反应生成C,由对氨基水杨酸钠的结构可知,应发生甲基的邻位取代,故C为 ,由于酚羟基、氨基易被氧化,故生成D的反应应为氧化反应,C被酸性高锰酸钾氧化生成D,则D为
,由于酚羟基、氨基易被氧化,故生成D的反应应为氧化反应,C被酸性高锰酸钾氧化生成D,则D为 ,D在碱性条件下水解生成E为
,D在碱性条件下水解生成E为 ,E在Fe、HCl、水条件下发生还原生成F为,则F为
,E在Fe、HCl、水条件下发生还原生成F为,则F为 ,F与碳酸氢钠反应生成氨基水杨酸钠,以此解答该题.
,F与碳酸氢钠反应生成氨基水杨酸钠,以此解答该题.解答:解:由对氨基水杨酸钠的结构可知A应为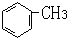 ,与浓硝酸,在浓硫酸、加热条件下发生硝化反应生成B,B有三种不同环境的氢,应发生对位取代,则B为
,与浓硝酸,在浓硫酸、加热条件下发生硝化反应生成B,B有三种不同环境的氢,应发生对位取代,则B为 ,B与溴在Fe作催化剂条件下发生取代反应生成C,由对氨基水杨酸钠的结构可知,应发生甲基的邻位取代,故C为
,B与溴在Fe作催化剂条件下发生取代反应生成C,由对氨基水杨酸钠的结构可知,应发生甲基的邻位取代,故C为 ,由于酚羟基、氨基易被氧化,故生成D的反应应为氧化反应,C被酸性高锰酸钾氧化生成D,则D为
,由于酚羟基、氨基易被氧化,故生成D的反应应为氧化反应,C被酸性高锰酸钾氧化生成D,则D为 ,D在碱性条件下水解生成E为
,D在碱性条件下水解生成E为 ,E在Fe、HCl、水条件下发生还原生成F为,则F为
,E在Fe、HCl、水条件下发生还原生成F为,则F为 ,F与碳酸氢钠反应生成氨基水杨酸钠,
,F与碳酸氢钠反应生成氨基水杨酸钠,
(1)由上述分析可知,A的结构简式为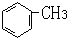 ,
,
故答案为: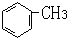 ;
;
(2)B→C的反应方程式为: ,
,
F→PAS-Na的反应方程式为: ,
,
故答案为: ;
; ;
;
(3)反应I是 与溴在Fe作催化剂条件下发生取代反应生成
与溴在Fe作催化剂条件下发生取代反应生成 ,
,
反应II是 发生氧化反应生成
发生氧化反应生成 ,
,
故答案为:取代反应;氧化反应;
(4)①上述转化中试剂X,Y和试剂Z分别是:试剂X为酸性高锰酸钾;试剂Y为Fe,HCl,H2O;试剂Z为,NaHCO3溶液,
故答案为:b;a;c;
②若上述转化物质C依次与试剂Y、NaOH溶液、试剂X作用,则为先将硝基还原,水解后再氧化甲基,还原生成的氨基会被氧化,水解生成酚会被氧化,故不可以,
故答案为:不可以,先将硝基还原,水解后再氧化甲基,还原生成的氨基会被氧化,水解生成酚会被氧化;
(5)同时符合下列要求的 的同分异构体:与FeCl3溶液能发生显色反应,含有酚羟基.属于芳香族化合物,含有苯环,分子中有两个取代基,含有一个硝基,则取代基为-OH、-CH2NO2,有邻、间、对三种位置关系,符合条件的结构简式为:
的同分异构体:与FeCl3溶液能发生显色反应,含有酚羟基.属于芳香族化合物,含有苯环,分子中有两个取代基,含有一个硝基,则取代基为-OH、-CH2NO2,有邻、间、对三种位置关系,符合条件的结构简式为: ,
,
故答案为: .
.
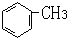 ,与浓硝酸,在浓硫酸、加热条件下发生硝化反应生成B,B有三种不同环境的氢,应发生对位取代,则B为
,与浓硝酸,在浓硫酸、加热条件下发生硝化反应生成B,B有三种不同环境的氢,应发生对位取代,则B为 ,B与溴在Fe作催化剂条件下发生取代反应生成C,由对氨基水杨酸钠的结构可知,应发生甲基的邻位取代,故C为
,B与溴在Fe作催化剂条件下发生取代反应生成C,由对氨基水杨酸钠的结构可知,应发生甲基的邻位取代,故C为 ,由于酚羟基、氨基易被氧化,故生成D的反应应为氧化反应,C被酸性高锰酸钾氧化生成D,则D为
,由于酚羟基、氨基易被氧化,故生成D的反应应为氧化反应,C被酸性高锰酸钾氧化生成D,则D为 ,D在碱性条件下水解生成E为
,D在碱性条件下水解生成E为 ,E在Fe、HCl、水条件下发生还原生成F为,则F为
,E在Fe、HCl、水条件下发生还原生成F为,则F为 ,F与碳酸氢钠反应生成氨基水杨酸钠,
,F与碳酸氢钠反应生成氨基水杨酸钠,(1)由上述分析可知,A的结构简式为
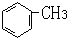 ,
,故答案为:
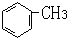 ;
;(2)B→C的反应方程式为:
 ,
,F→PAS-Na的反应方程式为:
 ,
,故答案为:
 ;
; ;
;(3)反应I是
 与溴在Fe作催化剂条件下发生取代反应生成
与溴在Fe作催化剂条件下发生取代反应生成 ,
,反应II是
 发生氧化反应生成
发生氧化反应生成 ,
,故答案为:取代反应;氧化反应;
(4)①上述转化中试剂X,Y和试剂Z分别是:试剂X为酸性高锰酸钾;试剂Y为Fe,HCl,H2O;试剂Z为,NaHCO3溶液,
故答案为:b;a;c;
②若上述转化物质C依次与试剂Y、NaOH溶液、试剂X作用,则为先将硝基还原,水解后再氧化甲基,还原生成的氨基会被氧化,水解生成酚会被氧化,故不可以,
故答案为:不可以,先将硝基还原,水解后再氧化甲基,还原生成的氨基会被氧化,水解生成酚会被氧化;
(5)同时符合下列要求的
 的同分异构体:与FeCl3溶液能发生显色反应,含有酚羟基.属于芳香族化合物,含有苯环,分子中有两个取代基,含有一个硝基,则取代基为-OH、-CH2NO2,有邻、间、对三种位置关系,符合条件的结构简式为:
的同分异构体:与FeCl3溶液能发生显色反应,含有酚羟基.属于芳香族化合物,含有苯环,分子中有两个取代基,含有一个硝基,则取代基为-OH、-CH2NO2,有邻、间、对三种位置关系,符合条件的结构简式为: ,
,故答案为:
 .
.点评:本题考查有机物的推断,题目难度中等,注意①-COOH由-CH3氧化而来,②-NH2由-NO2还原而得,故第一步反应-NO2引入到-CH3的对位上,③-OH由-X水解得,故第二步反应-Br引入到-CH3的邻位上,答题时注意体会.

练习册系列答案
 英才计划期末调研系列答案
英才计划期末调研系列答案 精英口算卡系列答案
精英口算卡系列答案
相关题目
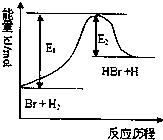 (2011?濮阳二模)参照反应Br+H2?HBr+H的能量对反应历程的示意图,下列叙述中正确的是( )
(2011?濮阳二模)参照反应Br+H2?HBr+H的能量对反应历程的示意图,下列叙述中正确的是( ) ,苹果酸可能发生的反应是( )
,苹果酸可能发生的反应是( )
 (2011?濮阳二模)A、B、C、D、E五种元素都是36号以前元素,原子序数依次增大,其相关信息如下表
(2011?濮阳二模)A、B、C、D、E五种元素都是36号以前元素,原子序数依次增大,其相关信息如下表