题目内容
【题目】在0.24 L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题。
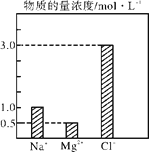
(1)该混合液中,NaCl的物质的量为______mol,含溶质MgCl2的质量为________g。
(2)该混合液中CaCl2的物质的量为________mol,将该混合液加水稀释至体积为1200mL,稀释后溶液中Ca2+的物质的量浓度为______mol·L-1。
(3)向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到沉淀________mol。
【答案】(1)0.24 11.4 (2)0.12 0.1 (3)0.72
【解析】
(1)根据图像可知钠离子的浓度是1.0mol/L,所以溶液中氯化钠的浓度是1.0mol/L,所以该混合液中,NaCl的物质的量为1.0mol/L×0.24L=0.24mol;溶液中镁离子的浓度是0.5mol/L,所以溶液中氯化镁的浓度是0.5mol/L,则含溶质MgCl2的质量为0.24L×0.5mol/L×95g/mol=11.4g;
(2)溶液中氯离子的浓度是3.0mol/L,所以根据溶液显电中性可知溶液中钙离子的浓度是![]() =0.5mol/L,因此该混合液中CaCl2的物质的量为0.5mol/L×0.24L=0.12mol;将该混合液加水稀释至体积为1.2 L,由于稀释后溶质的物质的量不变,则稀释后溶液中Ca2+的物质的量浓度为
=0.5mol/L,因此该混合液中CaCl2的物质的量为0.5mol/L×0.24L=0.12mol;将该混合液加水稀释至体积为1.2 L,由于稀释后溶质的物质的量不变,则稀释后溶液中Ca2+的物质的量浓度为![]() ;
;
(3)溶液中氯离子的物质的量是0.24L×3mol/L=0.72mol,所以根据方程式Ag++Cl-=AgCl↓可知向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到氯化银沉淀的物质的量是0.72mol。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案【题目】钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。
(1)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。若产生 6.72 L(标准状况下)氮气,至少需要叠氮化钠_____g。
(2)为实现金属钠在隔绝空气条件下与水反应并收集生成的气体,某研究 性学习小组设计了如图发生装置.
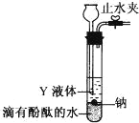
①写出 Na 与水反应的离子方程式_____。
②Y 液体可以选用_____
A.煤油 B.酒精 C.四氯化碳
③实验前检验该装置气密性的方法是:关闭止水夹,通过_________(填装置名称)向试管中加水至产生液面差,一段时间后,_____(填现象),则气密性良好。
(3)1mol 过氧化钠与 1.6mol 碳酸氢钠固体混合后,在密闭的容器中加热充分反应,排出气体物质后冷却,残留的固体物质及对应的物质的量(可不填满)。
物质 | 物质的量/mol |
__________ | __________ |
__________ | __________ |
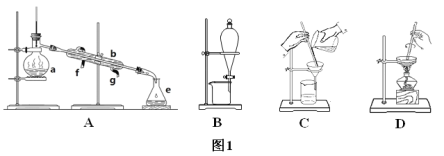
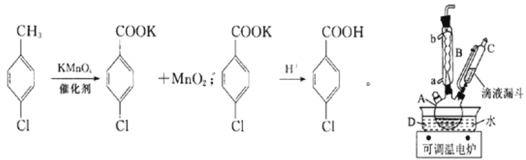
【题目】实验室中制备对氯苯甲酸的反应以及装置如图所示:
常温下,物质的有关数据和性质如表所示:
熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 颜色 | 水溶性 | |
对氯甲苯 | 7.5 | 162 | 1.07 | 无色 | 难溶 |
对氯苯甲酸 | 243 | 275 | 1.54 | 白色 | 微溶 |
对氯苯甲酸钾 | 具有盐的通性,属于可溶性盐 | ||||
实验步骤:在规格为250mL的仪器A中加入一定量的催化剂、适量KMnO4、100mL水;安装好装置,在滴液漏斗中加入6.00mL对氯甲苯,在温度为93℃左右时,逐滴滴入对氯甲苯;控制温度在93℃左右,反应2h,过滤,将滤渣用热水洗涤,使洗涤液与滤液合并,加入稀硫酸酸化,加热浓缩,冷却,然后过滤,将滤渣用冷水进行洗涤,干燥后称量其质量。
请回答下列问题:
(1)仪器A的名称为______________________。
(2)仪器B是冷凝管,其起到的主要作用是:________________,实验过程中,冷却水从________口。
(3)实验过程中两次过滤、洗涤操作,第一次过滤的滤渣成分为___________(填化学式),洗涤该滤渣用热水,目的是_________________________________,第二次过滤后,洗涤滤渣用冷水,目的是______________________。
(4)过滤、洗涤操作中能用到的仪器是___________(填选项字母)。
a.烧杯 b.分液漏斗 c.锥形瓶 d.玻璃棒
(5)第一次过滤后的滤液中加入硫酸,出现的现象是___________。
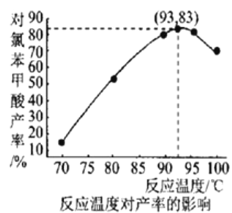
(6)如图是温度对对氯苯甲酸产率的影响关系,最后干燥、称量得到的对氯苯甲酸的质量为___________(保留小数点后两位)。