题目内容
某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路。课外活动小组为确认生产后的废液的组成,进行如下实验:(1)取10mL废液加入足量的AgNO3溶液,生成沉淀 8.61g。(2)另取10mL废液放入铜片充分反应,铜片质量减少了0.256g。下列关于原废液组成的判断错误的是
| A.一定含有Fe 2+、Fe 3+、Cu2+、Clˉ |
| B.c(Fe2+)︰c(Cu2+) = 2︰1 |
| C.c(Fe2+)︰c(Fe 3+) = 3︰1 |
| D.c(Clˉ) =" 6mol" / L,c(Fe 2+) =" 1.2mol" / L |
C
解析试题分析:这是Fe3+和Cu反应后的混合溶液根据2Fe3+ +Cu ===2Fe2+ +Cu2+的反应式,废液中Fe2+和Cu2+的浓度比必为2:1,生成8.61g AgCl沉淀,10mL溶液中有0.06molCl-;又已知10mL溶液可反应掉0.256g=0.004mol的Cu,可知10mL溶液中Fe3+=0.008mol,则这,10mL溶液中含有0.008molFeCl3,0.012molFe2+,0.06molCu2+可知答案C是错误的.
考点:Fe 3+和金属单质的反应

向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是
| A.a点对应的溶液中:Na+、Fe3+、SO42-、HCO3- |
| B.b点对应的溶液中:Ag+、Ca2+、NO3-、F- |
| C.c点对应的溶液中:Na+、S2-、SO42-、Cl- |
| D.d点对应的溶液中:K+、NH4+、I-、CO32- |
25 ℃、101 kPa下:①2Na(s) + 1/2O2(g)= Na2O(s) ΔH1=" -" 414 kJ·mol-1
② 2Na(s)+O2(g)= Na2O2(s) ΔH2=" -" 511 kJ·mol-1 ,下列说法正确的是 ( )
| A.①和②产物的阴阳离子个数比不相等 |
| B.①和②生成等物质的量的产物,转移电子数不同 |
| C.25 ℃、101 kPa下,Na2O2(s)+2Na(s)=2Na2O(s)ΔH=" -" 317 kJ·mol-1 |
| D.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 |
若m g Na在足量氯气中燃烧,生成固体的质量为(m+3.55 g),则m g Na与氧气反应,生成固体的质量可能为:①(m+0.8 g) ②(m+1.0 g) ③(m+1.2 g) ④(m+1.6 g) ⑤(m+1.4 g)
| A.①④ | B.①⑤ | C.③④ | D.①②③④⑤ |
甲、乙两烧杯中各盛有100mL3mol/L的硫酸和氢氧化钠溶液,向两烧杯中分别加入A克的铝粉,反应结束后测得生成的气体体积为甲:乙=3:4,下列说法正确的是
| A.参加反应的H2SO4为0.2mol | B.参加反应的NaOH约为0.27mol |
| C.加入铝粉的质量A=5.4 | D.与硫酸反应的铝粉的质量7.2g |
关于Na2CO3和NaHCO3性质的说法不正确的是( )
| A.热稳定性:NaHCO3<Na2CO3 |
| B.在水中的溶解性:NaHCO3<Na2CO3 |
| C.与盐酸反应的速率:NaHCO3<Na2CO3 |
| D.等物质的量的Na2CO3、NaHCO3分别与足量盐酸反应产生的CO2质量相同 |
在25℃、101kPa 下:①2Na(s)+1/2O2(g)=Na2O(s) △H1=-414KJ/mol
②2Na(s)+O2(g)=Na2O2(s) △H2=-511KJ/mol
下列说法正确的是( )
| A.①和②产物的阴阳离子个数比不相等 |
| B.①和②生成等物质的量的产物,转移电子数不同 |
| C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 |
| D.25℃、101kPa 下,Na2O2(s)+2 Na(s)= 2Na2O(s)△H=-317kJ/mol |
如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )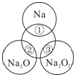
| A.Na2O2中阴阳离子数目之比为1:1 |
| B.反应①的离子方程式为:Na+2H2O=Na++2OH﹣+H2↑ |
| C.反应③最多能产生0.05mol O2 |
| D.①、②、③充分反应后所得溶液的质量分数从大到小:①>②>③ |