题目内容
【题目】类比pH的定义,对于稀溶液可以定义pc= -lgc,pKa= —lgKa。常温下,某浓度H2A溶液在不同pH值下,测得pc(H2A)、pc(HA-)、pc(A2-)变化如图所示。下列说法正确的是( )

A. pH=3.50时,c(H2A)>c(HA-)>c(A2-)
B. 将等浓度等体积的 Na2A 与 H2A 溶液混合后,溶液显碱性
C. 随着 HCl 的通入 c(H+)/c(H2A)先减小后增大
D. pH从3.00到5.30时,c(H2A)+c(HA-)+c(A2-)先增大后减小
【答案】C
【解析】
随pH的升高,c(H2A)减小、c(HA-)先增大后减小、c(A2-)增大, 所以pc(H2A)、pc(HA-)、pc(A2-)的变化曲线分别是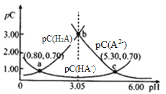 。
。
A. 根据图示,pH=3.50时, c(HA-)> c(A2-) >c(H2A),故A错误 ;
B.根据a点,H2A 的 Ka1=10-0.8,根据c点,H2A 的 Ka2=10-5.3,A2-的水解常数是![]() =10-8.7,等浓度等体积的 Na2A 与 H2A 溶液混合,电离大于水解,溶液显酸性,故B错误;
=10-8.7,等浓度等体积的 Na2A 与 H2A 溶液混合,电离大于水解,溶液显酸性,故B错误;
C. ,随着 HCl 的通入c(HA-)先增大后减小,所以c(H+)/c(H2A)先减小后增大,故C正确;
,随着 HCl 的通入c(HA-)先增大后减小,所以c(H+)/c(H2A)先减小后增大,故C正确;
D.根据物料守恒, pH从3.00到5.30时,c(H2A)+c(HA-)+c(A2-)不变,故D错误;答案选C。

【题目】某化学活动小组按下图所示流程由粗氧化铜样品(含少量氧化亚铁及不溶于酸的杂质)制取无水硫酸铜。

已知Fe3+、Cu2+、Fe2+三种离子在水溶液中形成氢氧化物沉淀的pH范围如下图所示:

请回答下列问题:
(1)已知25℃时,Cu (OH)2的Ksp=4.0×10-20调节溶液pH到4.0时,溶液C中Cu2+的最大浓度为____________mol·L1。
(2)在整个实验过程中,下列实验装置不可能用到的是________(填序号)。

(3)溶液A中所含溶质为__________________________;物质X应选用________(填序号)。
A.氯水 B.双氧水 C.铁粉 D.高锰酸钾
(4)从溶液C中制取硫酸铜晶体的实验操作为______________________________。
(5)用“间接碘量法”可以测定溶液A(不含能与I-发生反应的杂质)中Cu2+的浓度。过程如下:
第一步:移取10.00 mL溶液A于100 mL容量瓶中,加水定容至100 mL。
第二步:取稀释后溶液20.00 mL于锥形瓶中,加入过量KI固体,充分反应生成白色沉淀与碘单质。
第三步:以淀粉溶液为指示剂,用0.050 00 mol·L-1的Na2S2O3标准溶液滴定,前后共测定三次,达到滴定终点时,消耗Na2S2O3标准溶液的体积如下表:
(已知:I2+2S2O32-===2I-+S4O62-)
滴定次数 | 第一次 | 第二次 | 第三次 |
滴定前读数(mL) | 0.10 | 0.36 | 1.10 |
滴定后读数(mL) | 20.12 | 20.34 | 22.12 |
①CuSO4溶液与KI反应的离子方程式为______________________________。
②滴定终点的现象是____________________________________________________________。
③溶液A中c(Cu2+)=________mol·L-1。
(6)利用氧化铜和无水硫酸铜按下图装置,持续通入X气体,可以看到a处有红色物质生成,b处变蓝,c处得到液体且该液体有刺激性气味,则X气体是___________(填序号),写出其在a处所发生的化学反应方程式___________________________________________。

A.H2
B.CH3CH2OH(气)
C.N2