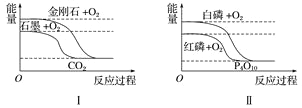
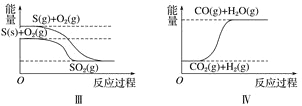
题目内容
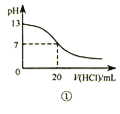
【题目】T℃时,在20.00 mL 0.10 mol·L-1CH3COOH溶液中滴入0.10 mol·L-1 NaOH溶液,溶液pH与NaOH溶液体积关系如图所示。下列说法正确的是
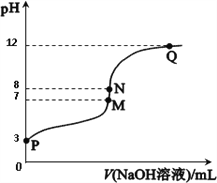
A. T℃时,CH3COOH电离平衡常数Ka=1.0×10-3
B. M点对应的NaOH溶液体积为20.0 mL
C. N点与Q点所示溶液中水的电离程度:N>Q
D. N点所示溶液中c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
【答案】C
【解析】A.pH=3的溶液中Ka=![]() ,故A正确;B.醋酸与NaOH完全中和时生成CH3COONa,溶液显碱性,M点溶液显中性,则对应的NaOH溶液体积小于20.0 mL,故B错误;C.N点主要是醋酸根离子水解促进水的电离,而Q点为过量的NaOH抑制水的电离,则两点所示溶液中水的电离程度:N>Q,故C正确;D.N点所示溶液为CH3COONa,显碱性,即c(OH-)>c(H+),存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),则溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故D错误;答案为C。
,故A正确;B.醋酸与NaOH完全中和时生成CH3COONa,溶液显碱性,M点溶液显中性,则对应的NaOH溶液体积小于20.0 mL,故B错误;C.N点主要是醋酸根离子水解促进水的电离,而Q点为过量的NaOH抑制水的电离,则两点所示溶液中水的电离程度:N>Q,故C正确;D.N点所示溶液为CH3COONa,显碱性,即c(OH-)>c(H+),存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),则溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故D错误;答案为C。

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
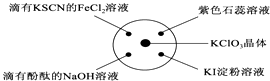
【题目】已知:KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O.如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好.下表中由实验现象得出的结论完全正确的是( )
选项 | 实验现象 | 结论 |
A | 滴有KSCN的FeCl2溶液变红 | Cl2具有还原性 |
B | 滴有酚酞的NaOH溶液褪色 | Cl2具有酸性 |
C | 石蕊试液先变红后褪色 | Cl2具有漂白性 |
D | KI淀粉溶液变蓝 | Cl2具有氧化性 |
A.A
B.B
C.C
D.D