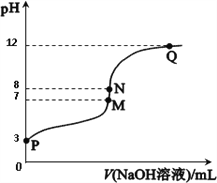
题目内容
【题目】下列各表述与示意图一致的是 ( )
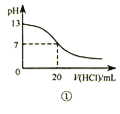


A. 图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
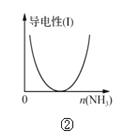
B. 图②表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化
C. 图③表示10 mL 0.01 mol·L-1 KMnO4 酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化
D. 图中④表示分别稀释10 mL pH=2的盐酸和醋酸时溶液pH的变化,图中b>100
【答案】D
【解析】A. 盐酸滴定NaOH溶液的滴定曲线在pH=7附近出现pH突越,图①没有出现pH突越,所以表述与示意图不一致;B. CH3COOH是弱酸,CH3COOH溶液中通入NH3生成易溶、易电离的物质醋酸铵,溶液导电性增强,所以表述与示意图不一致;C. 反应生成的Mn2+对该反应有催化作用,所以反应速率越来越快,故C错误;D. 分别稀释10 mL pH=2的盐酸和醋酸时,盐酸是强电解质,溶液pH的变化较快,若b=100,则醋酸溶液的pH<3,因此,醋酸溶液的pH=4时,b>100,故D正确。故选D。

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目