题目内容
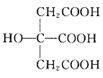
【题目】2018年3月南开大学教授叶萌春及其团队借助廉价金属镍和苯基硼酸共催化的烯基化反应,首次实现烯丙醇高效、绿色合成重大突破。成果也在最新一期《德国应用化学》上发表。丙烯醇的结构简式为CH2=CH-CH2OH。请回答下列问题:
(1)基态镍原子的价电子排布式为___________________。
(2)1 mol CH2=CH-CH2OH含____molσ键,烯丙醇分子中碳原子的杂化类型为____。
(3)丙醛(CHCH2CHO)的沸点为49℃,丙烯醇(CH2=CHCH2OH)的沸点为91℃,二者相对分子质量相等,沸点相差较大的主要原因是_______________________________。
(4)羰基镍[Ni(CO)4)用于制备高纯度镍粉,它的熔点为-25℃,沸点为43℃。羰基镍晶体类型是_________。
(5)Ni2+能形成多种配离子,如[Ni(NH3)6]2+、[Ni(CN)2]2-和[Ni(SCN)2]-等。NH3的空间构型是_____________。
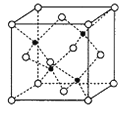
(6)NiO与NaCl的晶胞结构相似,如图所示,阴离子采取面心立方堆积,阳离子填充在位于阴离子构成的空隙中。
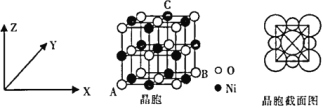
①氧化镍晶胞中原子坐标参数:A(0,0,0)、B(1,1,0),则C原子坐标参数为____________。
②已知:氧化镍晶胞密度为dg·cm-3,NA代表阿伏加德罗常数的值,则Ni2+半径为__________nm(用代数式表示)。
【答案】3d84s2 9 sp2、sp3 丙烯醇分子间存在氢键 分子晶体 三角锥形 (1/2,1,1) ![]()
【解析】
(1)根据镍是28号元素,结合核外电子的排布规律分析解答;
(2)丙烯醇分子中单键是σ键,双键中有1个σ键;烯丙醇分子中碳原子的杂化类型有2种,饱和碳原子和不饱和碳原子;
(3)根据丙烯醇分子之间存在除范德华力外,还存在氢键分析解答;
(4)根据羰基镍晶体的熔点低分析判断;
(5)根据价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=1/2×(a-xb)计算NH3中的N原子的价层电子对数,判断N原子的杂化类型,再判断空间构型;根据等电子体的概念分析解答;
(6)①立体坐标系类似平面坐标系,结合A、B两点的原子坐标分析判断;②观察氧化镍晶胞图,1个晶胞含4个“NiO”,面对角线上3个氧离子相切。由密度可以计算晶胞参数a;再计算氧离子半径,最后利用棱上镍离子、氧离子相切求出镍离子半径。
(1)镍是28号元素,基态镍原子的价电子排布式为3d84s2,故答案为:3d84s2;
(2)丙烯醇分子中单键是σ键,双键中有1个σ键,1个是π键,1 mol CH2=CH-CH2OH含9molσ键;烯丙醇分子中碳原子的杂化类型有2种,其中碳碳双键2端的碳原子采用sp2,亚甲基中碳原子采用sp3,故答案为:9;sp2、sp3;
(3)丙醛分子之间存在范德华力,丙烯醇分子之间存在除范德华力外,还存在氢键,氢键比范德华力强,使丙烯醇的沸点比丙醛高,故答案为:丙烯醇分子间存在氢键;
(4)羰基镍晶体的熔点为-25℃,沸点为43℃,熔沸点较低,属于分子晶体,故答案为:分子晶体;
(5)NH3中的N原子的价层电子对数=3+1/2×(5-3×1)=4,采用sp3杂化,N原子最外层有1个孤电子对,空间构型为三角锥形;故答案为:三角锥形;
(6)①氧化镍晶胞中原子坐标参数:A(0,0,0)、B(1,1,0),则C点对应的X轴为1/2,Y轴为1,Z轴为1,原子坐标参数为(1/2,1,1),故答案为:(1/2,1,1);
②设晶胞参数为a,观察氧化镍晶胞图,1个晶胞含4个“NiO”,面对角线上3个氧离子相切,d=75![]() /
/![]() a3,a=
a3,a=![]() ×107nm。因为棱上镍离子、氧离子相切。设氧离子半径为r,有:4r=
×107nm。因为棱上镍离子、氧离子相切。设氧离子半径为r,有:4r=![]() a,得:r=
a,得:r=![]() /4a。设镍离子半径为x,有:2r+2x=a,x=
/4a。设镍离子半径为x,有:2r+2x=a,x=![]()
nm。答案:![]()

 阅读快车系列答案
阅读快车系列答案【题目】过渡元素在生活、生产和科技等方面有广泛的用途。
(1)现代污水处理工艺中常利用聚合铁{简称PFS,化学式为[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10}在水体中形成絮状物,以吸附重金属离子。下列说法中不正确的是________(填序号)。
A.PFS中铁显+2价
B.铁原子的价电子排布式是3d64s2
C.由FeSO4溶液制PFS需经过氧化、水解和聚合的过程
D.由下表可知气态Fe2+再失去一个电子比气态Mn2+再失去一个电子难
Mn | Fe | ||
电离能 | I1 | 717 | 759 |
(kJ·mol-1) | I2 | 1 509 | 1 561 |
I3 | 3 248 | 2 957 |
(2)PFS中SO42-采取__________杂化,空间构型是_________。
(3)铬的配合物在药物应用、设计合成新磁材料领域和聚乙烯催化剂方面都有重要应用。现有铬与甲基丙烯酸根的配合物为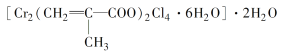
①该化合物中铬的化合价为___________。
②该化合物中一个Cr的配位数为________。
③甲基丙烯酸分子中C原子的杂化方式有___________________________________。
(4)O、S、Se为同主族元素,H2O、H2S和H2Se的参数对比见表.
化学式 | 键长/nm | 键角 |
H2O | 0.99 | 104.5° |
H2S | 1.34 | 92.3° |
H2Se | 1.47 | 91.0° |
H2S的键角大于H2Se的原因可能为__________________________________________________