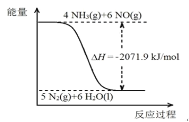
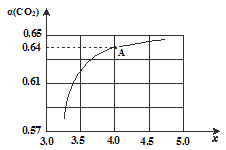
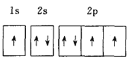
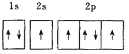
题目内容
【题目】![]() 是一种高效氧化剂,可用来氧化吸附有机异味物,也可以与水中的杂质如二价铁、锰、硫、氰、酚等反应.实验室常用
是一种高效氧化剂,可用来氧化吸附有机异味物,也可以与水中的杂质如二价铁、锰、硫、氰、酚等反应.实验室常用![]() 标准溶液标定未知浓度的
标准溶液标定未知浓度的![]() 溶液,发生反应
溶液,发生反应![]() ↑.
↑.
根据以上信息,完成下列问题:
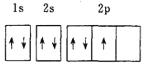
(1)按电子排布K位于元素周期表的________区,基态![]() 的核外电子排布式可表示为________.
的核外电子排布式可表示为________.
(2)![]() 中所含有的共价键数目为________.
中所含有的共价键数目为________.
(3)基态C原子的核外电子中占据最高能级的电子云轮廓图为________,![]() 中碳原子的轨道杂化类型是________.
中碳原子的轨道杂化类型是________.
(4)同主族元素氧、硫、硒对应最简单氢化物的沸点:![]() ,原因是________.
,原因是________.
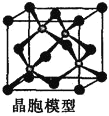
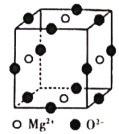
(5)![]() 的结构中Se为面心立方最密堆积,晶胞结构如图所示.
的结构中Se为面心立方最密堆积,晶胞结构如图所示.
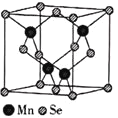
![]() 中Mn的配位数为________.
中Mn的配位数为________.
![]() 若该晶体的晶胞参数为apm,阿伏加德罗常数的值为
若该晶体的晶胞参数为apm,阿伏加德罗常数的值为![]() 则距离最近的两个锰原子之间的距离为________pm,
则距离最近的两个锰原子之间的距离为________pm,![]() 的密度
的密度![]() ________
________![]() 列出表达式
列出表达式![]() 。
。
【答案】![]()
![]() 或
或![]()
![]() 或
或![]() 哑铃形
哑铃形 ![]() 杂化 相对分子质量越大,范德华力就越大,沸点就越高,但水分子间能形成氢键,使水的沸点较高
杂化 相对分子质量越大,范德华力就越大,沸点就越高,但水分子间能形成氢键,使水的沸点较高 ![]()
![]()

【解析】
(1)K原子的价电子排布式是4s1,基态![]() 原子核外电子排布式可
原子核外电子排布式可![]() 3d54s2;
3d54s2;
(2)![]() 中
中![]() 与
与![]() 之间是配位键、
之间是配位键、![]() 内含有共价键;
内含有共价键;
(3)基态C原子的核外电子中占据的最高能级是2p,![]() 中含有O=C双键;
中含有O=C双键;
(4)同主族元素的氢化物,相对分子质量越大,范德华力就越大,沸点就越高,但水分子间能形成氢键;
(5)①根据晶胞图可知,每个Mn原子周围有4个Se原子与其成键,故![]() 中Mn的配位数;
中Mn的配位数;
②根据晶胞图可知,距最近的两个Mn原子之间的距离为面对角线的一半,![]() 的密度
的密度![]() 晶胞的摩尔质量÷(晶胞的体积×
晶胞的摩尔质量÷(晶胞的体积×![]() )。
)。
![]() 钾是19号元素,位于元素周期表第四周期ⅠA族,钾元素位于元素周期表的s区;根据构造原理可知,基态
钾是19号元素,位于元素周期表第四周期ⅠA族,钾元素位于元素周期表的s区;根据构造原理可知,基态![]() 的核外电子排布式为
的核外电子排布式为![]() 或
或![]() ;
;
![]() 中
中![]() 与
与![]() 之间是配位键、
之间是配位键、![]() 内含有共价键,1个
内含有共价键,1个![]() 中所含有的共价键数目
中所含有的共价键数目![]() ,则
,则![]() 中所含有的共价键数目为
中所含有的共价键数目为![]() 或
或![]() ;
;
![]() 的原子序数为6,基态C原子核外电子排布式为
的原子序数为6,基态C原子核外电子排布式为![]() ,电子占据最高能级p轨道的电子云轮廓图为哑铃形;
,电子占据最高能级p轨道的电子云轮廓图为哑铃形;![]() 是乙二酸
是乙二酸![]() 草酸
草酸![]() 的酸根,含有O=C双键,所以C原子的轨道杂化类型为
的酸根,含有O=C双键,所以C原子的轨道杂化类型为![]() 杂化;
杂化;
![]() 相对分子质量越大,范德华力就越大,氢化物的沸点就越高,但水分子间能形成氢键,氢键比范德华力强,故水的沸点较高;
相对分子质量越大,范德华力就越大,氢化物的沸点就越高,但水分子间能形成氢键,氢键比范德华力强,故水的沸点较高;
![]() ①由晶胞可知,每个Mn原子周围有4个Se原子与其成键,故
①由晶胞可知,每个Mn原子周围有4个Se原子与其成键,故![]() 中Mn的配位数为4;
中Mn的配位数为4;
②由晶胞结构图可知,每个晶胞中含Mn的个数为4,含有Se的个数为:![]() ,距最近的两个Mn原子之间的距离为面对角线的一半,即为
,距最近的两个Mn原子之间的距离为面对角线的一半,即为![]() ;晶胞密度
;晶胞密度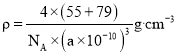 。
。