��Ŀ����
����Ŀ������ͼ��ʾװ�ý�������ʵ����
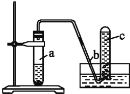
��1���ڼ��װ�õ������Ժ����Թ�a�м���10 mL 6 mol��L-1��ϡ�����1 gͭƬ�������ô��е��ܵ���Ƥ�������Թܿڡ���д�����Թ�a���п��ܷ�������Ӧ�Ļ�ѧ����ʽ_____________________��_____________________��
��2����ʵ������г�����Ӧ��ʼʱ���ʻ���������ӿ죬��������______________________������Ӧ����һ��ʱ���������������ԭ����_____________________________��
��3�����Ͽ���Ƶ�NO���ɲ�ȡ�Ĵ�ʩ��____________ (��д��ĸ���)��
A������ B��ʹ��ͭ�� C��ϡ��HNO3 D�����������Ũ��
���𰸡���1��3Cu+8HNO3(ϡ)3Cu(NO3)2+2NO��+4H2O��2�֣� 2NO+O22NO2��2�֣�
��2����ʼʱ��Һ�¶Ƚϵͣ���Ӧ���ʻ������÷�ӦΪ���ȷ�Ӧ�����ŷ�Ӧ�Ľ��У���Һ�¶�������Ӱ�컯ѧ��Ӧ���ʵ���Ҫ���أ��ʷ�Ӧ���ʼӿ죨2�֣�
��Ӧһ��ʱ���HNO3��Ũ�Ƚ�����Ӱ�컯ѧ��Ӧ���ʵ���Ҫ���أ��ʷ�Ӧ������������2�֣�
��3��AB��2�֣�
����������Ӧ��ʼʱ��Һ�¶Ƚϵͣ��ʷ�Ӧ���ʽ������÷�ӦΪ���ȷ�Ӧ�����ŷ�Ӧ�Ľ��У���Һ���¶������ߣ���Ӧ���ʼӿ죻��Ӧһ��ʱ���HNO3�����Ķ�Ũ�ȼ�С��HNO3��Ũ�ȳ�ΪӰ�췴Ӧ���ʵ���Ҫ���أ��ʷ�Ӧ���������������Ⱥ����ӹ���ĽӴ�������ܼӿ췴Ӧ���ʣ�ϡ��HNO3�����ʼ�С��Cu��Ũ���ᷴӦ�õ���������NO2��


