题目内容
10.常温下,下列溶液的pH=2的是( )| A. | 0.01mol•L-1的CH3COOH溶液 | B. | 0.1mol•L-1的H2SO4溶液 | ||
| C. | pH=0的H2SO4溶液稀100倍 | D. | c(OH-)=10-12mol•L-1的溶液 |
分析 常温下溶液的pH=2,则溶液中氢离子浓度为0.01mol/L,分别计算出各选项中氢离子浓度,然后进行判断,注意弱电解质在溶液中只能部分电离出氢离子,据此进行解答.
解答 解:常温下溶液的pH=2,则溶液中氢离子浓度为0.01mol/L,
A.0.01mol•L-1的CH3COOH溶液中,醋酸部分电离,则溶液中氢离子浓度小于0.01mol/L,溶液的pH>2,故A错误;
B.0.1mol•L-1的H2SO4溶液中,氢离子浓度为0.2mol/L,溶液的pH<2,故B错误;
C.pH=0的H2SO4溶液中氢离子浓度为1mol/L,稀100倍后溶液中氢离子浓度为0.01mol/L,稀释后溶液的pH=2,故C正确;
D.常温下(OH-)=10-12mol•L-1的溶液中,氢离子浓度为0.01mol/L,该溶液的pH=2,故D正确;
故选CD.
点评 本题考查了溶液pH的计算,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握溶液pH的表达式及计算方法,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案
相关题目
20.下列有关化学用语的表述中不正确的是( )
| A. | 1H、2H、H+都可说成是氢元素的不同微粒 | |
| B. | 16O2和18O2互为同位素,化学性质相同 | |
| C. | 铝原子的结构示意图: | |
| D. | 甲烷的结构式:CH4 |
1.下列分子中所有原子既不在同一直线上,又不在同一平面内的是( )
| A. | C2H4 | B. | C2H2 | C. | C6H6(苯) | D. | CH3-CH=CH2 |
2.化学与社会、生活和生产息息相关,以下叙述错误的是( )
| A. | 科学家们正在研究利用蓝绿藻等低等植物和微生物在阳光作用下使水分解产生氢气 | |
| B. | 贮氢金属在一定温度和压强下可以吸附氢气,如镧镍合金(LaNi5)可以吸附氢气形成LaNi5H6,其中H元素仍以H2分子形式存在 | |
| C. | 生活垃圾送入焚烧炉产生的热量可发电、供暖,焚烧炉产生的气体不可直接排放 | |
| D. | 2013年3月底,H7N9型禽流感在上海和安徽两地率先发现.要杀死禽流感病毒可通过消毒剂杀菌,通过加热煮沸杀菌,也可用紫外线照射杀菌 |
19.按钠、钾、铷、铯的顺序,下列有关叙述正确的是( )
| A. | 其氢氧化物中碱性最强的是NaOH | B. | 单质还原能力最强的是钠原子 | ||
| C. | 单质的熔点逐渐增大 | D. | 原子半径随核电荷数的增大而增大 |
 C7H16的同分异构体中具有“手性碳原子”的有2种,写出其中一种的名称3-甲基己烷(或2,3-二甲基戊烷).
C7H16的同分异构体中具有“手性碳原子”的有2种,写出其中一种的名称3-甲基己烷(或2,3-二甲基戊烷).

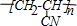 ,反应所属类型分别为加成反应、加聚反应.
,反应所属类型分别为加成反应、加聚反应.