题目内容
5.(1)学习化学,应多注重学习身边的化学,学以致用:①过氧化钠在太空及潜水艇中作为供氧剂的主要化学方程式是2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑
②装NaOH溶液的试剂瓶,为什么不能用玻璃瓶塞,用离子方程式解释SiO2+2OH-=SiO32-+H2O
③药品胃舒平(含有氢氧化铝)治疗胃酸(盐酸)过多的离子反应方程式Al(OH)3+3H+=Al3++3H2O
(2)学习物质,应多注重学习它的分类、物理性质、化学性质、特性、共性,以及与其它物质相比较所具有的相似性、不同点、联系及其用途等.
①浓盐酸、浓硝酸都要密封保存,若敞口放置,质量、浓度都会减小,因为都具有挥发性 性
②浓硫酸也要密封保存,若敞口放置,质量会增大,浓度会减小,因为具有吸水性 性
③浓、稀硫酸都有腐蚀性,但是浓硫酸还能使木材、纸张、蔗糖等有机物变黑碳化,这是因为浓硫酸还具有脱水性 性
④在常温下,浓硫酸、浓硝酸都能与铁、铝两种活泼金属单质反应,表面生成一层致密的氧化物薄膜而导致反应停止,这种现象叫钝化现象.
⑤(用化学式填空) 浓硫酸、稀硫酸虽然 都是硫酸,都有氧化性、酸性,但是浓度不同,反应、现象、原因、结果却不同.稀硫酸只与氢前的活泼金属反应,生成的气体是H2,与氢后的不活泼金属则不反应.浓硫酸既能与氢前活泼金属反应,又能与氢后某些不活泼金属反应,还能与某些非金属反应,生成的气体则是SO2
⑥(用化学式填空)浓硝酸、稀硝酸也是都有氧化性、酸性,但是与金属反应都不生成H2,浓硝酸与金属反应一般生成的气体是NO2,稀硝酸与金属反应一般生成的气体是NO.
分析 (1)①过氧化钠可以和水以及二氧化碳之间反应生成氧气;
②玻璃中含有二氧化硅,二氧化硅属于酸性氧化物和氢氧化钠溶液反应生成硅酸钠属于矿物胶;
③氢氧化铝可以和盐酸之间反应;
(2)①浓盐酸、浓硝酸具有挥发性;
②浓硫酸具有吸水性;
③浓硫酸具有脱水性;
④常温下铁、铝在浓硫酸、浓硝酸中发生钝化;
⑤稀硫酸是酸的氧化性和金属反应生成盐和氢气,发生置换反应,浓硫酸具有强氧化性和金属反应法氧化还原反应生成二氧化硫气体;
⑥稀硝酸和浓硝酸都具有强氧化性,稀硝酸被还原为一氧化氮,浓硝酸被还原为二氧化氮;
解答 解:(1)①过氧化钠与二氧化碳反应生成碳酸钠和氧气,方程式为:2Na2O2+2CO2=2Na2CO3+O2,过氧化钠与水反应生成NaOH和氧气,该反应为2Na2O2+2H2O=4NaOH+O2↑,
故答案为:2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑;
②玻璃中含有二氧化硅,二氧化硅属于酸性氧化物和氢氧化钠溶液反应生成硅酸钠属于矿物胶,瓶塞和瓶口粘结不能打开,反应的离子方程式为:SiO2+2OH-=SiO32-+H2O;
故答案为:SiO2+2OH-=SiO32-+H2O;
③氢氧化铝治疗胃酸(盐酸)过多的离子反应方程式为:Al(OH)3+3H+=Al3++3H2O;
故答案为:Al(OH)3+3H+=Al3++3H2O;
(2)①浓盐酸、浓硝酸都要密封保存,若敞口放置,质量、浓度都会减小,因为都具有挥发性,会发出氯化氢,硝酸分子,溶液质量减小;
故答案为:挥发性;
②浓硫酸具有吸水性,若敞口放置,吸收空气中的水蒸气,溶液质量会增大,浓度会减小,表现了浓硫酸的吸水性;
故答案为:吸水性;
③浓、稀硫酸都有腐蚀性,但是浓硫酸还能使木材、纸张、蔗糖等有机物变黑碳化,是浓硫酸把木材、纸张、蔗糖等有机物中 的氢元素恒温氧元素按照2:1脱去,发生碳化现象,表现了那看来是的脱水性;
故答案为:脱水性;
④在常温下,浓硫酸、浓硝酸都能与铁、铝两种活泼金属单质反应,表面生成一层致密的氧化物薄膜而导致反应停止.表现为浓硫酸的钝化现象;
故答案为:钝化;
⑤稀硫酸是酸的氧化性和金属反应生成盐和氢气,发生置换反应,浓硫酸具有强氧化性和金属反应法氧化还原反应生成二氧化硫气体;
故答案为:硫酸,H2、SO2;
⑥稀硝酸和浓硝酸都具有强氧化性,稀硝酸与金属反应稀硝酸一般被还原为一氧化氮,浓硝酸与金属反应一般浓硝酸被还原生成的气体为二氧化氮;
故答案为:硝酸,NO2、NO;
点评 本题考查了浓稀硫酸、浓稀硝酸、氮及其化合物性质的分析应用,主要是特征性质的理解应用,掌握基础是关键,题目较简单.

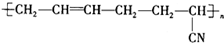 具有优良的耐油耐高温性能,合成丁腈橡胶的原料是( )
具有优良的耐油耐高温性能,合成丁腈橡胶的原料是( )①CH2=CH-CH=CH2 ②CH3-C≡C-CH3 ③CH2=CH-CN
④CH3-CH=CH-CN ⑤CH3-CH=CH2 ⑥CH3-CH=CH-CH3.
| A. | ③⑥ | B. | ②③ | C. | ①③ | D. | ④⑤ |
| A. | A>B>C | B. | B>C>A | C. | C>A>B | D. | B>A>C |
| A. | Al3+、NO3-、K+、SO42ˉ | B. | Ca2+、H+、CO32ˉ、AlO2- | ||
| C. | OH-、SO42-、NH4+、Ag+ | D. | Fe2+、Mg2+、H+、NO3ˉ |
| A. | 0.01mol•L-1的CH3COOH溶液 | B. | 0.1mol•L-1的H2SO4溶液 | ||
| C. | pH=0的H2SO4溶液稀100倍 | D. | c(OH-)=10-12mol•L-1的溶液 |
| A. | 离子化合物一定易溶于水 | |
| B. | 离子化合物由非金属元素和金属元素共同组成 | |
| C. | 熔融状态下能够导电的物质,一定是离子化合物 | |
| D. | 离子化合物在固态时有离子存在,但不导电 |
 高铁酸钾(K2FeO4)是一种绿色氧化剂,在许多领域展现出广阔的应用前景.
高铁酸钾(K2FeO4)是一种绿色氧化剂,在许多领域展现出广阔的应用前景.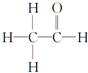 ,其PMR谱中有2个信号峰,其强度之比为3:1.
,其PMR谱中有2个信号峰,其强度之比为3:1.